Lymphozytentransformationstest (LTT)
Zahnersatzmaterialien können Allergien verursachen
Metalle, Acrylate (Kunststoffe) aber auch zahlreiche weitere, zum Beispiel in Wurzelfüllmaterialien oder Zementen enthaltene, Bestandteile können potentielle Allergene sein.
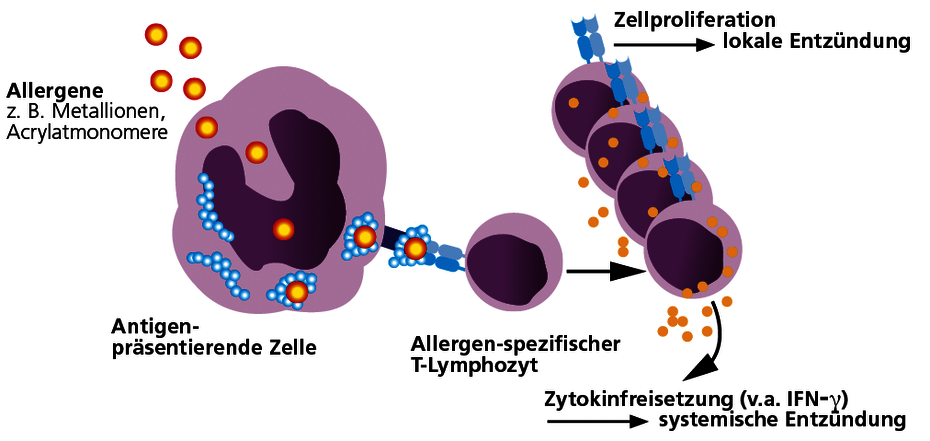
Sensibilisierungen auf zahnärztliche Werkstoffe beruhen bis auf wenige Ausnahmen auf Typ-IV-Sensibilisierungen (Allergien vom Spättyp). Metalle und Acrylate können körpereigene Eiweiße verändern und diese dadurch zum Allergen machen. Bei einer Typ-IV Sensibilisierung bilden sich spezifische T-Lymphozyten, die das Allergen bzw. allergenveränderte körpereigene Proteine (Hapteneffekt) als fremd erkennen. Bei sensibilisierten Patienten reagiert das Immunsystem nach Kontakt mit dem entsprechenden Allergen mit einer Immunaktivierung. Diese kann sich in einer Lokalsymptomatik äußern, aber auch systemische Entzündungsreaktionen verursachen oder verstärken.
Eine Sensibilisierung vom Typ IV auf ein Allergen besteht dann, wenn der Patient allergenspezifische T-Lymphozyten entwickelt hat. Der Nachweis erfolgt im LTT.
Wann muss man an eine allergisch bedingte Zahnmaterialunverträglichkeit denken?
Als lokale Zeichen können Stomatitiden, Lichen ruber planus, Gingivitis oder Parodontitis auftreten. Sie sind allerdings nicht obligat, da die oralen Schleimhäute immunologisch wenig reaktiv sind. Auf Grund der immunologischen Besonderheiten der Mundschleimhaut kommt es daher vor, dass Lokalsymptome wie Zungenbrennen oder Kiefer- und Zahnschmerzen nicht mit einem morphologischen Korrelat einhergehen.
Da Immunreaktionen prinzipiell systemischen Charakter tragen, können bei Typ IV-Allergien zahlreiche Allgemeinsymptome auftreten oder verstärkt werden. Zu diesen unspezifischen Entzündungssymptomen zählen: Abgeschlagenheit, Schlafstörungen, depressive Verstimmungen, Muskelschmerzen, Arthralgien (Fibromyalgie), Parästhesien, Kopfschmerzen, Migräne oder auch Neuralgien.
Zudem ist bekannt, dass bei sensibilisierten Patienten eine dauerhafte Exposition mit Metallionen (u.a. Quecksilber, Gold, Nickel) Autoimmunität auslösen kann.
Mit dem LTT lassen sich allergenspezifische T-Lymphozyten nachweisen.
Der LTT ist eine Labormethode zum Nachweis einer spezifischen zellulären Sensibilisierung. Der Test basiert auf dem Prinzip der Allergen spezifisch induzierten Zellteilung von Lymphozyten nach Kontakt mit ihrem „passenden“ Allergen. Eine positive Reaktion im LTT beweist die Existenz von Allergen-spezifischen Lymphozyten (Gedächtniszellen) im Blut des Patienten.
Es gibt zwei Fragestellungen, die mit dem LTT beantwortet werden:
- Ist ein Ersatz des vorhandenen Zahnersatzmaterials notwendig?
Mit dem LTT kann ein Zusammenhang zum Material nachgewiesen bzw. ausgeschlossen werden, wenn nach dem Einbringen von Zahnersatzmaterial Beschwerden auftreten (kurative Fragestellung). - Welche Materialien können verwendet bzw. nicht verwendet werden?
Mit dem LTT können vor dem Einbringen neuer Zahnersatzmaterialien bestehende Sensibilisierungen auf alle enthaltenen Bestandteile ausgeschlossen werden (präventive Fragestellung).
Auf welche Materialien kann im LTT getestet werden?
Prinzipiell kann im LTT auf nahezu alle Zahnersatzmaterialien getestet werden, sofern im Labor ein zytotoxischer Effekt oder unspezifisch aktivierende Faktoren ausgeschlossen werden.
Für häufig wiederkehrende Fragestellungen wurden die nachfolgenden Profile entwickelt, in denen die bekannten sensibilisierenden Einzelallergene standardisiert untersucht werden.
| LTT-Metalle | Gold, Nickel, Palladium, Chrom, Kobalt, Molybdän, Aluminium, Platin, Cadmium, Quecksilber, Kupfer, Silber, Zinn, Ethylquecksilber |
| LTT-Kunststoffe | Methylmethacrylat (MMA/PMMA), TEGDMA, BISGMA, BISDMA, HEMA, Diurethandimethacrylat, Ethylenglycoldimethacrylat, Buthandiol-1-4-methacrylat, N,N-Dimethyl-4-toluidin, Benzoylperoxid, Hydrochinon, Campherchinon, Phthalate, Formaldehyd |
| LTT-Kombi-Profil (Dentalcheck) | Gold, Nickel, Palladium, Chrom, Kobalt, Platin, Quecksilber, Kupfer, Silber, Zinn, Methylmethacrylat (MMA/PMMA), HEMA, TEGDMA, BISGMA |
| LTT-Goldlegierungen | Gold, Silber, Platin, Kupfer, Palladium, Zinn, Gallium, Indium, Iridium, Rhodium, Tantal, Ruthenium |
| LTT-Amalgam | Amalgambestandteile und organische Quecksilberverbindungen: Quecksilber, Kupfer, Silber, Zinn (Amalgam), Ethylquecksilber, Phenylquecksilber, Methylquecksilber |
| LTT-Wurzelfüllmaterialien | Rohguttapercha, Perubalsam, Eugenol, Polydimethylsiloxan, Silikonöl, Bismutoxid, Silber, Terpentinöl, Kolophonium, Triethanolamin, Erdnussöl, Paraformaldehyd, Bisphenol A, Epichlorhydrin |
| LTT-Keramik + Zemente | Vanadium, Aluminium, Titan, Kobalt, Chrom, Barium, Silicium, Cer, Bor, Mangan, Antimon, Phosphatzement (Harvard), Glasionomerzement (Ketac-Bond) |
| LTT-Nativmaterial | Untersuchung auf selektiv ausgewählte Materialien, die auch mit ins Labor geschickt werden können. |
Zur ausführlichen Diagnostik der Titanunverträglichkeit verweisen wir auf das Kapitel Titanunverträglichkeit.

Hinweis zum Befund: Die Ursache lag hier nicht im zahnärztlichen Bereich, sondern konnte in einem Pd/Ni-Piercingmaterial identifiziert werden.

Hinweis zum Befund: Der Befund einer Patientin zeigt die seltene Konstellation einer Ko-Sensibilisierung auf Methylmethacrylat, TEGDMA und HEMA. Die Methylmethacrylat-Sensibilisierung war aufgrund einer allergischen Kontaktdermatitis auf Acrylat-haltige künstliche Fingernägel vermutet worden. Hier sollten zukünftig nicht nur die künstlichen Fingernägel sondern auch z.B. Medikamente mit Acrylatkapseln vermieden werden. Bei Prothesenkunststoffen oder Schienenmaterial muss gewährleistet sein, dass keine MMA-Freisetzung erfolgt. Auf Grund der bestehenden Sensibilisierung auf TEGDMA und HEMA kommen nur TEGDMA- und HEMA-freie Füllungskunststoffe oder Kleber in Betracht, z.B. ELS-Kunststoff der Firma Saremco, Schweiz. Dieser Kunststoff enthält BISGMA auf welches hier aktuell keine Allergie besteht.
Die hier vorliegende Konstellation einer Mehrfachsensibilisierung ist sehr selten. In ca. 80% der Fälle besteht die Sensibilisierung nur auf Methylmethacrylat (MMA). Ein Kontakt zu MMA ist bereits im Kindesalter über Klebstoffe oder Pflaster gegeben. Sensibilisierungen auf Dimethacrylate sind seltener, trotzdem aber für 20% der positiven LTT-Analysen verantwortlich. Allerdings haben sie weitreichendere Konsequenzen, da Sensibilisierungen auf Dimethacrylate auch bei Kunststofffüllungen oder Klebern berücksichtigt werden müssen.
Gibt es kostengünstige Kombinationsprofile?
Insbesondere für präventive Testungen wurde ein Kombinationsprofil (Dentalcheck) mit den wichtigsten Metallen und Acrylaten entwickelt, welches folgende Problembereiche abdeckt:
- Goldlegierungen (Gold, Silber, Palladium, Platin, Kupfer und Zinn)
- NEM-Legierungen (Chrom, Kobalt, Nickel)
- Amalgam (Quecksilber, Silber, Kupfer, Zinn)
- Prothesenkunststoffe (MMA/PMMA)
- Acrylathaltige Komposite und Zemente (HEMA, TEGDMA, BISGMA)

Hinweis zum Befund: Die Untersuchung erfolgte aufgrund des Verdachtes auf Amalgamunverträglichkeit. Diese hat sich durch den positiven LTT auf anorganisches Quecksilber bestätigt.
Die deutliche Sensibilisierung auf Gold war ein Zufallsbefund. Erst im Nachhinein gab die Patientin auf Befragen an, dass sie Goldschmuck prinzipiell nicht mehr trägt, da sich in früheren Jahren Entzündungszeichen z.B. an den Ohrläppchen gezeigt hatten. Der Befund war insofern wichtig, weil der Ersatz der Amalgamfüllungen durch Goldlegierungen somit streng kontraindiziert war.
Die Sensibilisierung auf Methylmethacrylat hatte keine unmittelbaren aktuellen zahnmedizinischen Konsequenzen. Der Patientin wurde jedoch geraten, künstliche Fingernägel streng zu meiden (auch wegen der Gefahr der Inhalation von MMA in den Nagelstudios) sowie Retardmedikamente (MMA-Kapsel) und Acrylatfarben. Es wurde ein Allergiepass ausgestellt.
Kann auch auf native und individuelle Materialien getestet werden?
Ja, wenn die Materialien zusammen mit der Blutprobe ins Labor eingesendet werden. Bewährt hat sich dieses Verfahren insbesondere bei komplexen Materialien, wie z.B. Zementen, Kompositen, Prothesenmaterialien, Knochenersatzmaterialien, Wurzelfüllmaterialien (auch Stifte) sowie intraoral gewonnenen Metall- und Kunststoffspänen.
Bei negativ getesteten Materialien ist ausgeschlossen, dass gegenüber darin enthaltenen (deklarierten oder nicht deklarierten) Bestandteilen eine Sensibilisierung vorliegt. Im LTT positiv getestete Materialien dürfen dagegen keinesfalls eingebracht werden, da auf mindestens ein enthaltenes Allergen eine Typ IV-Sensibilisierung besteht.
Hinweis: Gängige in der Zahnmedizin verwendete Nativmaterialien sind im Labor vorrätig. Bitte rufen Sie uns unter +49 30 77001-220 an und lassen sich diese Liste per Fax zusenden.

Hinweis zum Befund: Getestet wurde auf vier mit eingesendete Substanzen bzw. Materialien. Der Befund zeigt eine Sensibilisierung auf ein Wurzelfüllmaterial. Die Nachtestung konnte beweisen, dass dieser Befund auf einer Sensibilisierung gegenüber Eugenol beruht. (Nachtestung hier nicht dargestellt).
Hinweis: Um die Produktneutralität zu wahren, wurde der Name des Präparates geschwärzt.
LTT-Wurzelfüllmaterial
Auf Guttapercha, aber auch auf die in Sealern enthaltenen Bestandteile, können allergische Sensibilisierungen vorliegen. Die bekannten Allergene sind im Profil LTT-Wurzelfüllmaterial enthalten.

Hinweis zum Befund: Befund eines Patienten bei dem Jahre nach Wurzelbehandlungen apikale Entzündungen an mehreren Zähnen auftraten. Außerdem bestand der Verdacht auf eine allergisch induzierte Kontaktdermatitis, deren Beginn zeitlich mit der Wurzelbehandlung in Einklang zu bringen war. Die damals verwendeten Sealer konnten nicht mehr ermittelt werden, weshalb hier das Profil LTT-Wurzelfüllmaterialien gewählt wurde in dem gängige Inhaltsstoffe untersucht werden. Wenn die Materialien bekannt gewesen wären, hätte man die Untersuchung des unmittelbar verwendeten Nativmaterials gewählt. Aus der Anamnese war bei dem Patienten eine allergische Pflasterunverträglichkeit bekannt, was sehr wahrscheinlich darauf beruht, dass (braunes) Pflaster Kolophonium enthält (wobei prinzipiell auch an Methylmethacrylat zu denken wäre).
Als Konsequenz des Befundes wurden die Zähne je nach klinischem und radiologischem Befund zum Teil entfernt bzw. die Wurzelfüllung revidiert. Die verwendeten Materialien (frei von Eugenol und Kolophonium) wurden als Nativmaterial vorher untersucht. Wegen der Sensibilisierung auf Rohguttapercha wurde ein (ebenfalls vorgetestetes) synthetisches Guttapercha verwendet.
Bei der Allergietestung auf Guttapercha wird natürliches Rohguttapercha verwendet. Vor allem bei präventiven Fragestellungen kann es sinnvoll sein, das spezifisch zur Verwendung anstehende Guttaperchapräparat (auch Stifte) im LTT als Nativmaterial zu testen, da z.B. synthetisch hergestelltes Guttapercha oder verarbeitete natürliche Rohstoffe nicht mehr alle Allergenkomponenten des Rohguttaperchas enthalten müssen.
Um die Bedeutung der im LTT-Profil enthaltenen Bestandteile darzustellen, sind nachfolgend die (bekannten) wichtigen Bestandteile häufig verwendeter temporärer oder permanenter Wurzelfüllmaterialien angegeben.
Die Inhaltsstoffe wurden den Sicherheitsdatenblättern oder den Produktinformationen entnommen. Für die Richtigkeit und die Vollständigkeit kann unsererseits keine Gewähr übernommen werden.
| N2 Endodontic Cement® | enthält u.a. Paraformaldehyd, Titanoxid, Zinkoxid (Pulver) und Eugenol, Rosenöl, Lavendelöl, Erdnussöl (Flüssigkeit) |
| Endomethasone® | enthält u.a. Thymoljodid, Zinkoxid, Hydrocortisonazetat (Pulver) und Eugenol (Flüssigkeit) |
| AH Plus® | Bisphenol A Diglycidylether, Bis-[4-(-2,3epoxypropoxy)phenyl]methane, PDMS |
| AH26® | enthält u.a. Bismutoxid, Methenamin, Titanoxid, Silber |
| Aptal-Harz Wurzelfüllung® | enthält u.a. Zinkoxid, Kolophonium (Pulver), Eugenol, Perubalsam, Terpentinöl (Flüssigkeit) |
| Rocanal Permanent Vital R2® | enthält u.a. Anisöl, Phenylphenol (Pulver), Eugenol, Kolophonium, Rizinusöl (Flüssigkeit) |
| Hermetic® | enthält u.a. Zinkoxid, Zinkstearat, Zirkonium(IV)oxid (Pulver), Eugenol, Perubalsam (Flüssigkeit) |
| Super EBA® | enthält u.a. Eugenol (Flüssigkeit), Zinkoxid, Aluminiumoxid (Pulver) |
| Apexit Plus® | enthält u.a. Calciumhydroxid, Calciumoxid, Kolophonium |
| Guttapercha-Stifte | können je nach Anbieter enthalten Zinkoxid, gereinigte Guttapercha, Kolophonium (1 - 4,1%), Schwermetalle 1,5 - 30 %, evtl. Pigmente, Lebensmittelfarbstoffe |
Welche Konsequenzen sind aus einem positiven LTT-Ergebnis zu ziehen?
Ein positives Resultat im LTT sagt aus, dass gegenüber dem betreffenden Allergen eine Sensibilisierung vom Typ IV besteht. Zukünftig darf kein Material verwendet werden, welches dieses Allergen enthält (präventive Aussage). Im Falle einer kurativen Fragestellung sollte beachtet werden, dass mit keinem Allergietest (auch nicht mit dem Epikutantest) der unmittelbare kausale Zusammenhang zur bestehenden Beschwerdesymptomatik zu beweisen ist.
Daher muss bei einer nachgewiesenen Sensibilisierung sorgfältig abgewogen werden, ob das jeweilige Problemmaterial entfernt und ersetzt werden sollte. Entscheidend ist dabei die klinische Symptomatik, keinesfalls ein positives Testergebnis allein. Andere Expositionsquellen sind primär oder gleichzeitig zu eliminieren (ausführliche Informationen zu anderen Expositionsquellen erhalten Sie mit jedem LTT-Befund).
Im Einzelfall kann bei nachgewiesener Sensibilisierung und unklarer klinischer Bedeutung mit einer nachfolgend durchgeführten Effektorzelltypisierung die Kausalitätsbeziehung zwischen der Sensibilisierung und der klinischen Manifestation weitergehend untersucht werden.
Was wird für den LTT benötigt?
Für jedes Untersuchungsprofil werden 20 ml Heparin- und 5 ml Vollblut zur Serumgewinnung benötigt.
Das Abnahme- und Versandmaterial wird vom Labor zur Verfügung gestellt. Die Blutentnahmesets sind von allen gängigen Herstellern verfügbar.
Bitte kontaktieren Sie unsere Mitarbeiter der regionalen Praxisbetreuung oder unser Servicepersonal im Labor, welche alle organisatorischen Fragen gerne für Sie beantworten.
Wie erfolgt die Blutentnahme?
Im Regelfall schicken Zahnärzte ihre Patienten mit dem Blutentnahmeset und dem ausgefüllten Anforderungsschein zum Hausarzt, welcher das Blut abnehmen kann.
Einige Zahnärzte nehmen auch selbst Blut ab. In Berlin kann die Blutentnahme auch in unserem Labor erfolgen. Gerne informieren wir Sie darüber.
Wie gelangen die Patientenproben in das Labor?
Der Probenversand erfolgt per Kurier oder im Einzelfall auch per Post.
Ein vorfrankiertes Versandkuvert ist in jedem LTT-Blutabnahmeset enthalten. Die Einsendung erfolgt immer am Tag der Blutabnahme. Das Blut muss innerhalb von 24 h im Labor sein.
Wie wird der LTT abgerechnet?
Die Abrechnung erfolgt durch das Labor direkt mit dem Patienten.
Bei Privat-Versicherten ist der LTT unter der Ziffer 3694 abrechenbar. Zahnärzte sind berechtigt, diese Leistungen im Labor zu veranlassen.
Im Bereich der Gesetzlichen Krankenversicherung sind LTT-Untersuchungen mit zahnärztlichen Fragestellungen keine Kassenleistungen.
Die Abrechnung für Selbstzahler erfolgt hier zu einem reduzierten Satz direkt mit dem Patienten (Preise siehe Anforderungsschein).
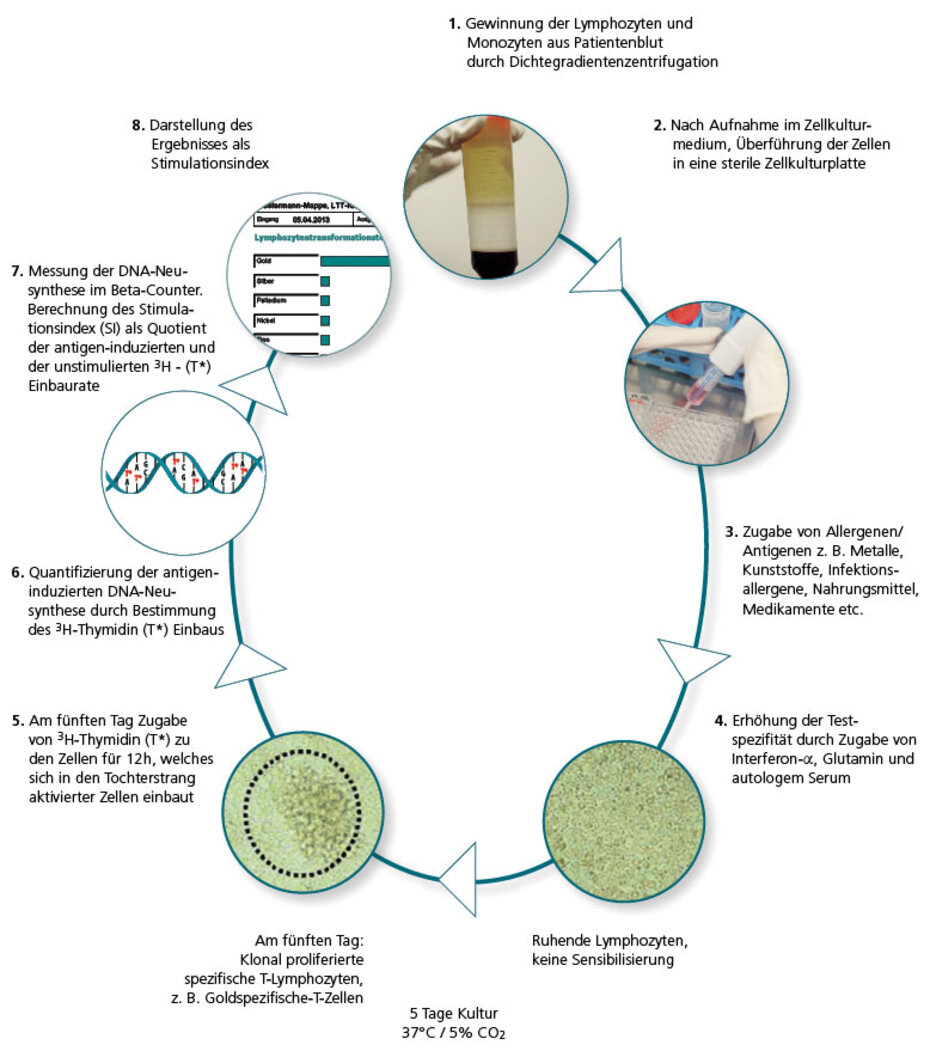
Durchführung des LTT
Beim LTT werden die Lymphozyten im Labor aus einer Blutprobe des Patienten gewonnen und mit den jeweils zu testenden Allergenen in drei parallelen Ansätzen „konfrontiert“. Wenn beim Patienten allergenspezifische T-Lymphozyten vorhanden sind, kommt es innerhalb der nächsten 6 Tage zur klonalen Zellproliferation. Diese wird anhand der DNA-Synthese quantifiziert.
Die Allergen-induzierte Lymphozytenvermehrung wird in Relation zur spontanen Proliferation (Leerwert) gesetzt und ergibt als Ergebnis den Stimulationsindex (SI).
Was unterscheidet den LTT von heute gegenüber früher verwendeten Methoden?
Noch um 2000 hatte der LTT eine relativ geringe Empfindlichkeit. Bei der Diagnostik von Typ IV-Allergien war er dem Hauttest allenfalls gleichwertig, wenn nicht sogar unterlegen.
Die heute in immunologischen Speziallaboratorien angewandten LTT-Technologien zeichnen sich durch eine hohe Sensitivität und Spezifität aus. Dazu beigetragen haben die Weiterentwicklungen der Zellkulturtechniken und -medien, die Reinheit der zur Zellstimulation verwendeten Allergene und die heute zur Verfügung stehenden grundlegend verbesserten Messmethoden für die 3H-Thymidin-Aktivitätsbestimmung.
Zur Entwicklung der Methodik hat die Verwendung von gentechnisch hergestelltem Interferon-α als Zusatz in der Zellkultur beigetragen (von Baehr et al, J. Immunol. Methods 2001; 251: 63-71). Durch diese im Jahre 2005 im IMD Berlin eingeführte optimierte LTT-Variante konnte die Sensitivität und die Spezifität, vor allem im Vergleich zu der damals noch gängigen MELISA®-Methodik, signifikant verbessert werden.
Der LTT ist als Labormethode akkreditiert.
Beim Lymphozyten-Transformations-Test handelt es sich um ein anspruchsvolles Laborverfahren. Neben einer kostenintensiven Laborausstattung sind große Erfahrung und Sorgfalt beim durchführenden Laborpersonal erforderlich, da bei diesem Test nur wenige Arbeitsschritte automatisierbar sind. Die Basis der Zellkultur ist auch in unserem modernen Technologiezeitalter noch die gute alte „Handarbeit“, die durch erfahrene und in der Zellkultur geschulte Mitarbeiter erfolgen muss.
Des Weiteren ist die analytische Qualität vom Grad der Standardisierung im jeweiligen Labor abhängig und von der Methodik die für jedes einzelne Allergen etabliert und validiert wurde. Aus diesem Grund sollten zelluläre Analyseverfahren nur durch speziell darauf orientierte Fachlaboratorien und Institute durchgeführt werden, wo diese Verfahren nach DIN 15189 von der nationalen Akkreditierungsstelle der Bundesrepublik Deutschland (DAkkS) akkreditiert sind.
Im IMD-Berlin wurde der LTT schon 2004 nach DIN 15189 akkreditiert und seitdem regelmäßig überwacht.
Für zahnmedizinische Fragestellungen ist der LTT dem Epikutantest (ECT) vorzuziehen.
Zum Nachweis von Typ IV-Sensibilisierungen stehen mit dem LTT und dem Epikutantest zwei voneinander unabhängige Testmethoden zur Verfügung. Diese können sich bei einigen Fragestellungen (z.B. in der Berufsdermatologie) gut ergänzen. Für zahnmedizinische Fragestellungen ist der LTT dem ECT aber aus den folgenden Gründen vorzuziehen:
- Der LTT ist sensitiver bei systemischen Sensibilisierungen.
Der Epikutantest ist zum Nachweis einer Kontaktallergie validiert, d.h. bei Allergien, wo die Sensibilisierung durch Hautkontakt stattgefunden hat bzw. sich an der Haut manifestiert. Bei Allergenen, die über Schleimhäute aufgenommen werden, spricht man von systemischen Sensibilisierungen. Hier hat der LTT Vorteile hinsichtlich der Sensitivität, da er mit Blutzellen durchgeführt wird.
Mit dieser Begründung wurde der LTT auch für den Nachweis von Sensibilisierungen auf Medikamente in die allergologischen Leitlinien aufgenommen und von der Leitlinienkommission des Robert-Koch-Institut als „uneingeschränkt empfehlenswert“ eingestuft. Auch wenn die dermatologischen Berufsverbände es bis heute in Frage stellen, werden Allergene aus Zahnersatzmaterialien ähnlich wie Medikamente über die Schleimhäute und nicht über die äußere Hautbarriere aufgenommen.
Der logische Schluss, hier ebenfalls den LTT zu empfehlen, scheitert bisher wohl eher an der fehlenden Wertschätzung der Problematik „Unverträglichkeit von Zahnersatzmaterial“ als an immunpathologischen Argumenten gegen den LTT.
Die Sensitivität des LTT wird heute mit 90 bis 95% in Abhängigkeit vom Testallergen angegeben. Die Spezifität ist abhängig von der Validierung jedes einzelnen Allergens und der Qualität der LTT-Durchführung. In einem nach DIN 15189 akkreditierten Labor sind falsch positive Befunde durch unspezische Aktivierungen durch interne Standardisierung auszuschließen. - Beim LTT kommt der Patient nicht mit dem Allergen in Kontakt.
Durch den beim Epikutantest unvermeidbaren direkten Kontakt des Patienten mit dem Allergen kann dieser durch den Test selbst sensibilisiert werden. Das ist beim LTT nicht möglich, da die „Konfrontation“ an einer entnommenen Blutprobe im Labor stattfindet. Problematisch beim Epikutantest ist, dass im Falle einer stattfindenden Sensibilisierung, diese in dem betreffenden Epikutantest nicht zu erkennen ist.
Erst mit einem zweiten Epikutantest, frühestens 10-14 Tage später, wäre die Sensibilisierung nachweisbar. Diese zweite „Testung“ führt aber paradoxerweise dann der Zahnarzt durch, wenn er das Ersatzmaterial in den Organismus einbringt. Daher ist der Epikutantest für vorbeugende Testungen sogar kontraindiziert.
Auch karzinogene und toxische Substanzen sollten nie auf die Haut eines Patienten aufgebracht werden, weshalb sich ihr Einsatz im Epikutantest verbietet.
Die Kommission „Methoden und Qualitätssicherung“ des Robert-Koch-Institutes fasst die Vorteile des LTT folgendermaßen zusammen:
- Der LTT birgt keine Risiken für den Patienten, da anders als beim Epikutantest keine Induktion einer Sensibilisierung oder Verstärkung der klinischen Symptome durch diese in vitro-Labormethode möglich ist.
- Die LTT-Ergebnisse sind nicht von der Hautbeschaffenheit abhängig.
- Beim LTT kann durch „gewissenhafte Etablierung und Validierung“ das Risiko falsch positiver Resultate minimiert werden.
„Qualitätssicherung beim Lymphozytentransformationstest“ - Addendum zum LTT-Papier der RKI-Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“ Mitteilung der Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“ Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2008;51:1070-1076
Literatur
- Boscolo P, Di Giampaolo L, Reale M, Castellani ML, Ritavolpe A, Carmignani M, Ponti J, Paganelli R, Sabbioni E, Conti P, Di Gioacchino M. Different effects of platinum, palladium, and rhodium saltson lymphocyte proliferation and cytokine release. Ann Clin Lab Sci. 2004;34:299-306.
- Cavani A. et al. Human CD25+ regulatory T cells maintain immune tolerance to nickel in healthy, nonallergic individuals. J. of Immunology. 2003;171:5760-5768.
- Christiansen J, Färm G, Eid-Forest R, Anderson C, Cederbrant K, Hultman P. Interferon-gamma secreted from peripheral blood mononuclear cells as a possible diagnostic marker for allergic contact dermatitis to gold. Contact Dermatitis. 2006;55:101-112.
- Cederbrant K, Hultman P, Marcusson JA, Tibbling L. In vitro lymphocyte proliferation as compared to patch test using gold, palladium and nickel. Int Arch Allergy Immunol. 1997;112:212-217.
- Cederbrant K, Gunnarsson LG, Hultman P, Norda R, Tibbling-Grahn L. In vitro lymphoproliferative assays with HgCl cannot identify patients with systemic symptoms attributed to dental amalgam. J Dent Res. 1999;78:1450-1458.
- Di Gioacchino M, Verna N, Di Giampaolo L, Di Claudio F, Turi MC, Perrone A, Petrarca C, Mariani-Costantini R, Sabbioni E, Boscolo P. Immunotoxicity and sensitizing capacity of metal compounds depend on speciation. Int J Immunopathol Pharmacol. 2007;20:15-22.
- Everness KM, Gawkrodger DJ, Botham PA, Hunter JA. The discrimination between nickel-sensitive and non-nickel-sensitive subjects by an in vitro lymphocyte transformation test. Br J Dermatol. 1990;122:293-298.
- Farrer DG, Hueber SM, McCabe MJ Jr. Lead enhances CD4+ T cell proliferation indirectly by targeting antigen presenting cells and modulating antigen-specific interactions. Toxicol Appl Pharmacol. 2005;207:125-137.
- Hagemann T, Schlutter-Bohmer B, Allam JP, Bieber T, Novak N. Positive lymphocyte transformation test in a patient with allergic contact dermatitis of the scalp after short-term use of topical minoxidil solution. Contact Dermatitis. 2005;53:53-55.
- Hallab NJ, Caicedo M, Finnegan A, Jacobs JJ. Th1 type lymphocyte reactivity to etals in patients with total hip arthroplasty. J Orthop Surg. 2008;13(3):6.
- Hallab NJ, Anderson S, Stafford T, Glant T, Jacobs JJ. Lymphocyte responses in patients with total hip arthroplasty. J Orthop Res. 2005;23:384-391.
- Hallab NJ. Lymphocyte transformation testing for quantifying metal-implant-related hypersensitivity responses. Dermatitis. 2004,15:82-90.
- Jakobson E, Masjedi K, Ahlborg N, Lundeberg L, Karlberg AT, Scheynius A. Cytokine production in nickel-sensitized individuals analysed with enzyme-linked immunospot assay: possible implication for diagnosis. Br J Dermatol. 2002;147(3):442-449.
- Kanerva L, Jolanki R, Estlander T. 10 years of patch testing with the (meth)acrylate series. Contact Dermatitis. 1997;37:255-258.
- Kanerva L, Estlander T. Contact leukoderma caused by patch testing with dental acrylics. Am J Contact Dermat. 1998;9:196-198.
- Kapsenberg ML et al. Th1 lymphokine production profiles of nickel-specific CD4+T-lymphocyte clones from nickel contact allergic and non-allergic individuals. J Invest Dermatol. 1992;98:59-63.
- Lindemann M et al. ELISpot: a new tool for the detection of nickel sensitization. Clin. Exp. Allergy 2003;33:992-998.
- Lindemann M, Rietschel F, Zabel M, Grosse-Wilde H. Detection of chromium allergy by cellular in vitro methods. Clin Exp Allergy. 2008;38(9):1468-1475.
- van Loon LA, van Elsas PW, van Joost T, Davidson CL. Contact stomatitis and dermatitis to nickel and palladium. Contact Dermatitis.1984;11:294-297.
- Martin SF, Merfort I, Thierse HJ. Interactions of chemicals and metal ions with proteins and role for immune responses. Mini RevMed Chem. 2006;6(3):247-255.
- Merk HF. Allergische Berufsdermatosen, Stellungnahme zur In vitro-Diagnostik. Hautarzt. 2004;55:31-34.
- Merk HF. Lymphocyte transformation test as a diagnostic test in allergic contact dermatitis. Contact Dermatitis. 2005;53:246.
- Minang JT, Areström I, Troye-Blomberg M, Lundeberg L, Ahlborg N. Nickel, cobalt, chromium, palladium and gold induce a mixed Th1- and Th2-type cytokine response in vitro in subjects with contact allergy to the respective metals. Clin Exp Immunol. 2006;146:417-426.
- Moed H, von Blomberg M, Bruynzeel DP, Scheper R, Gibbs S, Rustemeyer T. Improved detection of allergen-specific T-cell responses in allergic contact dermatitis through the addition of ‚cytokine cocktails‘. Exp Dermatol. 2005;14:634-640.
- Moneret-Vautrin D.A. Allergy to nickel in dental alloys. Europ. Annals of Allergy and Clin Immunol. 2004;36:311-312.
- Müller K, Valentine-Thon E. Hypersensitivity to titanium: clinical and laboratory evidence. Neuro Endocrinol Lett. 2006;27(1):31-35.
- Rasanen L, Tuomi ML. Diagnostic value of the lymphocyte proliferation test in nickel contact allergy and provocation in occupational coin dermatitis. Contact Dermatitis. 1992;27:250-254.
- RKI-Empfehlung, Diagnostische Relevanz des Lymphozytentransformationstest in der Umweltmedizin. Gesundheitsschutz. 2002;45:745-749.
- Rustemeyer T, De Ligter S, Von Blomberg BM, Frosch PJ, Scheper RJ. Human T lymphocyte priming in vitro by haptenated autologous dendritic cells. Clin Exp Immunol. 1999;117:209-216.
- Rustemeyer T, von Blomberg BM, van Hoogstraten IM, Bruynzeel DP, Scheper RJ. Analysis of effector and regulatory immunereactivity to nickel. Clin Exp Allergy. 2004;34:1458-1466.
- Spiewak R, Moed H, von Blomberg BM, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. Allergic contact dermatitis to nickel: modified in vitro test protocols for better detection of allergen-specific response. Contact Dermatitis. 2007;56:63-69.
- Temesvasi E et al. Nickel sensitivity from dental prothesis. Contact Dermatitis 1988;18:50-51.
- Thierse HJ, Gamerdinger K, Junkes C, Guerreiro N, Weltzien HU. T cell receptor (TCR) interaction with haptens: metal ions as non-classical haptens. Toxicology. 2005;15(209):101-107.
- Thomas P, Bandl WD, Maier S, Summer B, Przybilla B. Hypersensitivity to titanium osteosynthesis with impaired fracture healing, eczema, and T-cell hyperresponsiveness in vitro: case report and review of the literature. Contact Dermatitis. 2006;55:199-202.
- Trattner A, Akerman L, Lapidoth M, Klein T, Weiss H, Ben Chaim B, David M. Use of in vitro release of interferon-gamma in the diagnosis of contact allergy to potassium dichromate - a controlled study. Contact Dermatitis. 2003;48:191-193.
- Valentine-Thon E, Müller K, Guzzi G, Kreisel S, Ohnsorge P, Sandkamp M. LTT-MELISA is clinically relevant for detecting and monitoring metal sensitivity. Neuro Endocrinol Lett. 2006;27:17-24.
- Vamnes JS, Gjerdet NR, Morken T, Moe G, Matre R. In vitro lymphocyte reactivity to gold compounds in the diagnosis of contact hypersensitivity. Contact Dermatitis. 1999;41:156-160.
- von Baehr V, Mayer W, Liebenthal C, von Baehr R, Bieger W, Volk HD. Improving the in vitro antigen specific T cell proliferation assay: the use of interferon-alpha to elicit antigen specific stimulation and decrease bystander proliferation. J Immunol Methods. 2001;251:63-71.
- Wolf R, Davidovici B, Marcos B, Orion E. Lymphocyte transformation test in patients with allergic contact dermatitis. Contact Dermatitis. 2005;53(4):245.
- Yaqob A, Danersund A, Stejskal VD, Lindvall A, Hudecek R, Lindh U. Metal-specific lymphocyte re-activity is downregulated after dental metal replacement. Neuro Endocrinol Lett. 2006;27:189-197.