Belastung mit Metallen
Metallbelastung des Speichels durch Zahnersatz
Je nach Zusammensetzung, Zustand, Lage und Größe geben metallische Zahnersatzmaterialien durch Abrieb und Korrosion unterschiedliche Mengen an Metallen in den Speichel und in das umliegende Gewebe ab. In Einzelfällen kann dies eine lokale oder auch generalisierte Entzündung des Zahnfleisches verursachen. Da Metalle des Speichels durch Verschlucken in den Magen-Darmtrakt gelangen, ist auch eine Reizung der somit ebenfalls exponierten Schleimhäute des Magendarmtraktes möglich.
Über ihre lokale Wirkung hinaus steigert eine dauerhaft erhöhte intestinale Metallexposition das Risiko für eine systemische Belastung des Organismus. So werden chronische Metallbelastungen als Triggerfaktoren für die Entwicklung von zahlreichen chronisch entzündlichen Erkrankungen diskutiert. Gut belegt ist der Zusammenhang u.a. für Erschöpfungszustände, Bluthochdruck und neurologische Störungen. Für die Art und den Umfang der Symptomatik ist neben dem Ausmaß der Metallbelastung auch die individuelle Suszeptibilität des Patienten von Bedeutung.
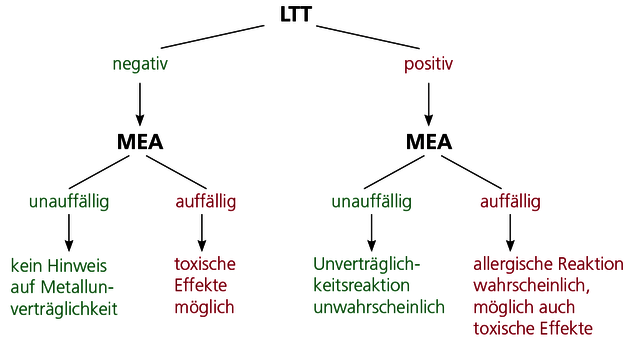
Toxische Metallwirkungen können auch bei negativem LTT auftreten
Metalle können über zwei Mechanismen auf den Organismus einwirken. Zum einen können bei individuell bestehenden Sensibilisierungen (nachweisbar über den LTT) schon sehr geringe Belastungen eine Typ-IV-Immunreaktion hervorrufen. Die dann bei andauernder Belastung resultierende dauerhafte Immunaktivierung kann alle Facetten einer chronischen Entzündung umfassen, wie z.B. Verstärkung lokaler Entzündungsvorgänge, Autoimmunreaktionen und Fatigue. Die Diagnostik der Typ IV-Allergie ist im Kapitel Lymphozytentransformationstest umfassend dargestellt.
Gleichzeitig jedoch können Metalle wie z.B. Quecksilber, Cadmium und Palladium schon in niedriger Dosis toxisch wirken und zelluläre Stoffwechselvorgänge hemmen. Auch sehr niedrige (subtoxische) Konzentrationen sind bereits von möglicher klinischer Relevanz, da Mehrfachbelastungen (auch aus Nahrung und Trinkwasser!) die toxische Wirkung des einzelnen Metalls potenzieren können. Toxische Wirkungen treten auch ohne vorliegende allergische Sensibilisierung auf. Das bedeutet, dass einerseits bei negativem LTT-Befund eine toxische Belastung möglich ist, dass andererseits aber auch bei positivem LTT zusätzlich toxische Metallbelastungen eine klinische Bedeutung haben können.
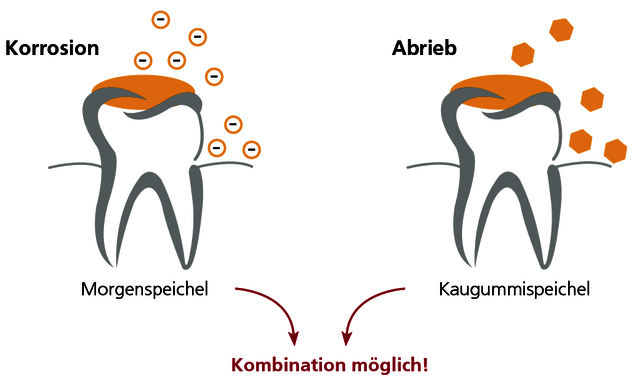
Die Wahl der Speichelabgabe richtet sich nach der Indikation!
Der Morgenspeichel dient dem sensitiven Nachweis von Korrosion. Aufgrund des verminderten Speichelflusses während der Nacht reichern sich die freigesetzten Ionen an und liegen in höherer Konzentration vor als tagsüber. Vorsicht jedoch bei Bruxismus: Durch das nächtliche Knirschen werden Abriebpartikel freigesetzt, die unabhängig von Korrosion zu hohen Metallspiegeln im Morgenspeichel führen.
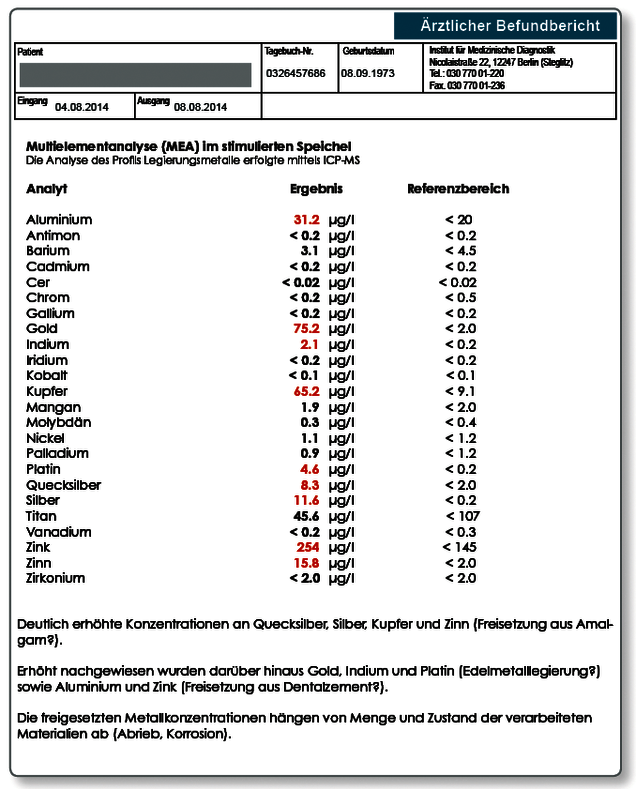
Der Kaugummispeichel dient hingegen dem sensitiven Nachweis von mechanischem Abrieb von Metallpartikeln aus dem Zahnersatz. Dabei wird durch 10-minütiges Kaugummikauen der Abrieb stimuliert und dann die Speichelprobe gesammelt. Abrieb findet vor allem an „weichen“ Goldlegierungen (z.B. Biogold) und an Amalgam statt.
Der kombinierte Speichel wird in der Praxis meist gewählt, da die Unterscheidung zwischen Korrosion und Abrieb oft nicht im Vordergrund steht. Hier werden Morgenspeichel und Kaugummispeichel möglichst zu gleichen Teilen in dasselbe Sammelröhrchen abgegeben. Die Analyse des kombinierten Speichels gibt einen Hinweis auf die Gesamtmetallbelastung, welche der Patient über seinen Speichel ausgesetzt ist.
Speichelmetalle stammen nicht nur aus Dentallegierungen!
Studien zeigen, dass die Metallfreisetzung in den Speichel auch aus Lotstellen (Silber, Kupfer), Dentalzementen (Aluminium, Antimon, Zink) und sogar (meist unterbrannten) Keramiken (Aluminium, Barium, Zink) stattfinden kann. Wie für die Freisetzung aus Legierungen stellt auch hier der pH-Wert in der Mundhöhle eine wichtige Einflussgröße dar. Darüber hinaus ist zu beachten, dass Rückstände aus Zahnpflegeprodukten (Titan, Zinn) und aus Lebensmitteln und Getränken (z.B. Barium aus dem Trinkwasser) gerade im Morgenspeichel messbar sein können. Ferner sind manche Legierungsmetalle als physiologische Elektrolyte im Speichel enthalten (Kupfer, Mangan, Zink). Daher können Verschiebungen im Elektrolythaushalt die Belastung aus dem Zahnersatz überlagern.
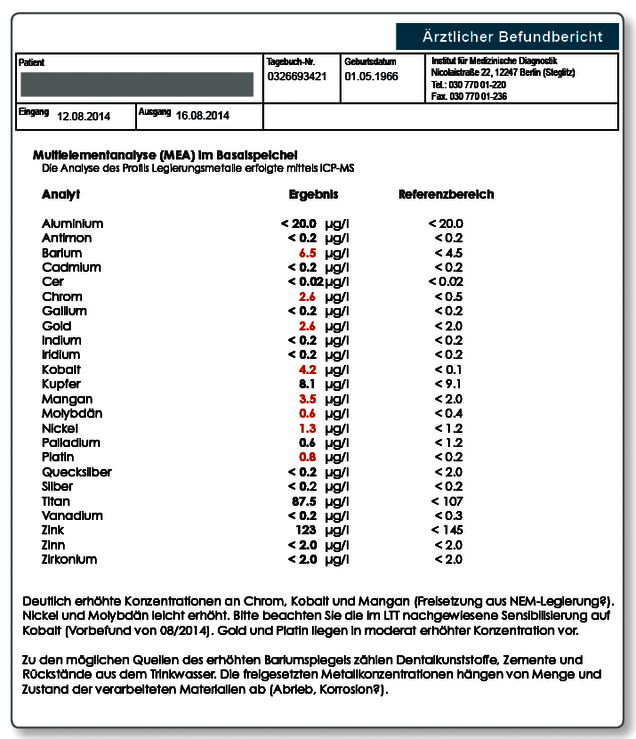
Hinweis zum Befund: Die Indikation für die Untersuchung einer Speichelprobe war hier nicht der unmittelbare Verdacht auf eine toxische Belastung, sondern die Konsequenz eines positiven Allergietests auf Kobalt (Lymphozytentransformationstest SI 6,7). Insofern stand die Frage, ob eine Freisetzung von Kobalt aus dem aktuellen Zahnersatz nachweisbar ist. Da es um Kobalt ging, wurde Morgenspeichel gewählt und nicht der Kaugummitest. Im Unterschied zur Fragestellung der alleinigen toxischen Belastung ist bei bestehender allergischer Sensibilisierung jeder messbare Wert im Speichel von Relevanz. In Konsequenz dieses Speichelergebnisses wurde der NEM-Zahnersatz entfernt, auch wenn der definitive Beweis, dass die Beschwerden der Patientin tatsächlich einen unmittelbaren Zusammenhang zu dem Metall haben, mit keinem Labortest definitiv erbracht werden kann.
Hinweis zum Befund: Die Indikation für die Untersuchung einer Speichelprobe wurde in diesem Fall gestellt, da die Patientin über Sodbrennen und Gastritis klagte und der Zahnarzt primär eine toxische Belastung der Schleimhaut in Erwägung zog. Das Ergebnis zeigt, dass mindestes bei einer Goldlegierung ein massiver Abrieb zu verzeichnen ist, was den Verdacht auf eine „weiche“ Biogoldlegierung lenkte. Die erhöhten Werte für Quecksilber, Kupfer, Zinn und Silber deuten dagegen auf Abrieb aus zwei noch vorhandenen Amalgamfüllungen hin. Interessant ist der erhöhte Wert für Aluminium. Als dentale Quelle kommen hier Dentalzemente in Frage, die im Unterschied zu Klebern in unterschiedlichem Ausmaß alle Aluminium enthalten.
Die ICP-MS ist das sensitivste Analyseverfahren.
Die Multielementanalyse (MEA) mittels ICP-MS („inductively coupled plasma mass spectrometry“) bietet die Möglichkeit, in einer Speichelprobe zahlreiche Metalle gleichzeitig nachzuweisen. Die Sensitivität ist gegenüber des herkömmlichen Verfahrens der Atomabsorption wesentlich verbessert und reicht bis in den Konzentrationsbereich ng/L. Zur Messung wird die Probe in feinste Tröpfchen zerstäubt, die dann in einem 8000°C heißen Argongas-Plasma in ihre Elementbestandteile zerfallen. Die entstehenden Metallionen werden dann im angeschlossenen Massenspektrometer analysiert.
Benötigtes Probenmaterial
3-5 ml Speichel. Auf Anfrage schicken wir Ihnen gern Speichelröhrchen
| Morgenspeichel | Abgabe unmittelbar nach dem Erwachen, vor Frühstück und Zahnpflege |
| Kaugummispeichel | Abgabe nach 10-minütigem Kaugummikauen |
| kombinierter Speichel | Abgabe von Morgenspeichel und Kaugummispeichel in dasselbe Röhrchen |
Abrechnung
Die Untersuchung gehört nicht zum Leistungsspektrum der Gesetzlichen Krankenkassen (GKV). Die Kosten betragen für Selbstzahler 104,92 €. Für privat versicherte Patienten betragen die Kosten 120,66 €. Privatkassen übernehmen bei gegebener Indikation die Kosten ohne Probleme.
Da die Abrechnung pro Material erfolgt, stellt die Analyse des kombinierten Speichels eine aussagefähige und kosteneffektive Alternative dar.
- Elshahawy et al. Elemental ion release from fixed restorative materials into patient saliva. J Oral Rehabil. 2013;40:381-388.
- Esquivel-Upshaw et al. Surface Degradation of Dental Ceramics as a Function of Environmental pH. J Dent Res. 2013;92:467-471.
- Freitas et al. Release of toxic ions from silver solder used in orthodontics: an in-situ evaluation. Am J Orthod Dentofacial Orthop. 2011;140:177-181.
- Jennrich. Schwermetalle. Ursache für Zivilisationskrankheiten. CO’MED Verlagsgesellschaft mbH. Hochheim 2007.
- Monaci et al. Concentrations of Major Elements and Mercury in Unstimulated Human Saliva. Biol Trace Elem Res. 2002;89:193-203.
- Niedermeier. Biologie und Zahnersatz. Rheinisches Zahnärzte Blatt. 2013;11:601-604.
- Pizzichini et al. Release of mercury from dental amalgam and its influence on salivary antioxidant activity. The Science of the Total Environment. 2002;284:19-25.
- Richardson et al. Mercury exposure and risks from dental amalgam in the US population, post-2000. Science of the Total Environment. 2011;409:4257-4268.
- Shenoy und Shenoy. Dental ceramics: An update. J Conserv Dent. 2010;13:195-203.
- Steinberg et al. Influence of Dental Biofilm on Release of Mercury from Amalgam Exposed to Carbamide Peroxide. J Biomed Mater Res B Appl Biomater. 2003;67:627-631.
- Tamam und Aydin, Surface characterization of passive film and elemental release analysis of a Ni–Cr alloy during bleaching, part I: effects of different bleaching agents. Clin Oral Investig. 2011;15: 375-382.
Systemische Symptomatiken durch systemische Metallbelastung?
Von der Exposition im Mundraum strikt zu unterscheiden ist die systemische Belastung des Organismus, da der Darm nur einen Teil der Metalle aus dem verschluckten Speichel resorbiert. Die Frage nach der systemischen Metallbelastung durch den Zahnersatz stellt sich insbesondere dann, wenn ein kausaler Zusammenhang zu systemischen Symptomatiken vermutet wird. Da korrodierender oder stark abreibender Zahnersatz eine permanente Expositionsquelle darstellt, ist die systemische Aufnahme der freigesetzten Metalle sehr gut mittels Multielementanalyse im Morgenurin oder im EDTA-Blut messbar. Dabei ist zu beachten, dass die systemische Belastung neben dem Zahnersatz aus zahlreichen weiteren Quellen stammt, wie z.B. aus der Nahrung, dem Trinkwasser, der Atemluft sowie möglichen endogenen Quellen (z.B. Endoprothesen).
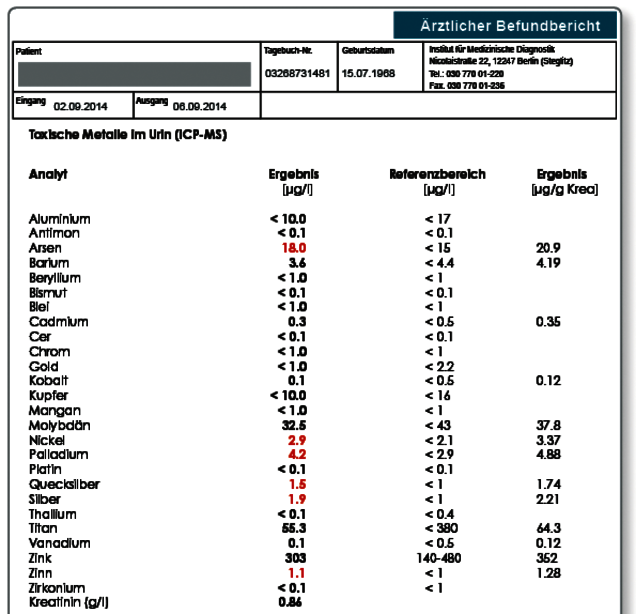
Hinweis zum Befund: Insbesondere die erhöhten Konzentrationen an Gold, Nickel, Palladium, Quecksilber, Silber und Zinn könnten von einer Belastung durch Zahnersatz herrühren. Dies kann die parallele Multielementanalyse im Speichel klären. Eine andere mögliche Expositionsquelle stellt die Nahrung dar.
Befund: Hinweis auf eine systemische Belastung mit Arsen, Nickel, Palladium, Quecksilber, Silber und Zinn.
Metallbelastungen können aus vielfältigen Quellen stammen. Die nachfolgenden Hinweise sollen Anhaltspunkte für die Identifizierung der individuell relevanten Expositionsquellen liefern und mögliche biologische Effekte der nachgewiesenen Metallbelastungen darstellen. Dabei gilt grundsätzlich für viele Metalle, dass sie dosis-abhängig in Endothelien und Immunzellen Entzündungsprozesse auslösen und durch die Induktion von oxidativem Stress zelluläre Membranen, Proteine und DNA schädigen können.
Die Hinweise erheben keinen Anspruch auf Vollständigkeit und ersetzen nicht die klinische Auswertung der Laborergebnisse durch den behandelnden Arzt.
Arsen:
Wichtige Expositionsquellen sind: Fisch, Meeresfrüchte, Meeresalgen, Müllverbrennung, Tabakrauch, Obstbau, importierter Wein.
Systemische biochemische Effekte bei Belastung können sein: Arsen hemmt die Produktion und die Aktivität von ATP; blockiert die DNA-Reparatur (Gentry et al., Environ mol mutagenesis 2010;51:1-14).
Nickel:
Wichtige Expositionsquellen sind: Nüsse, Bananen, Kaffee, Kakao, Schokolade, Trinkwasser
(v.a. wenn in Armaturen abgestanden), Dentalwerkstoffe, zahntechnische Lote, Endoprothesen, Modeschmuck, Piercing, Tattoofarben, Kosmetika, Textilfarben, Besteck, Töpfe, Kaffeemaschinen, Industrieemissionen, Tabakrauch, Tonerstaub.
Systemische biochemische Effekte bei Belastung können sein: Schädigung der DNA durch Verdrängung von Magnesium aus dem Heterochromatin, Modifikation der epigenetischen Prägung, Aktivierung der Leukotrien-B4-Synthese in Granulozyten, Induktion allergischer Sensibilisierungen (Klein et al., Pathobiology 1994; 62: 90-8).
Palladium:
Wichtige Expositionsquellen sind: Dentallegierungen, Schmuck, Farbstoffe, Piercing.
Systemische biochemische Effekte bei Belastung können sein: oxidativer Stress durch Glutathion-Verbrauch, Induktion allergischer Sensibilisierungen (Mukhtiar et al., Pak J Pharm Sci 2013;26:131-5).
Quecksilber:
Wichtige Expositionsquellen sind: Amalgam, Fisch, Meeresfrüchte, Energiesparlampen, Neonröhren, Kontaktlinsenreiniger.
Systemische biochemische Effekte bei Belastung können sein: Verminderte Entgiftungsleistung durch Hemmung der Glutathion-Peroxidase, verdrängt Eisen und Kupfer, mitochondriale Dysfunktion, oxidativer Stress, nach Umwandlung durch Darmbakterien in Methylquecksilber Passage der Blut-Hirn-Schranke, Induktion allergischer Sensibilisierungen (Farina et al., Neurochem Int. 2013; 62:1-20).
Silber:
Wichtige Expositionsquellen sind: Trinkwasserfilter, Antiseptika, Fotoentwickler, Textilien, Kosmetika, Amalgam und andere Dentallegierungen, Schmuck.
Systemische biochemische Effekte bei Belastung können sein: Reagiert mit Thiolgruppen, und anderen funktionellen Gruppen von Proteinen/Enzymen, zerstört Zellmembranen, stört Mitochondrienstoffwechsel, Induktion allergischer Sensibilisierungen (Garcia-Reyero et al., Environ Sci Technol. 2014; 48: 4546-55).
Zinn:
Wichtige Expositionsquellen sind: Konservendosen, Modeschmuck, Amalgam und andere Dentallegierungen, Dentalzemente, Zahnpflegemittel (Zinnfluorid), Anstrichfarben, Tonerstaub.
Systemische biochemische Effekte bei Belastung können sein: Induktion allergischer Sensibilisierungen. Hoch toxische organische Zinnverbindungen können mit der angewandten Methode nicht von weniger giftigem anorganischen Zinn unterschieden werden (Pagliarani et al., Toxicol In Vitro. 2013; 27: 978-90).
Die kumulative Gesamtbelastung ist nach Ausleitung messbar.
Vor allem bei chronischer Belastung wird von entsprechend ausgebildeten Umweltmedizinern der basalen Urinanalyse oft die Multielementanalyse im Urin nach Gabe von Chelatbildnern (z.B. DMPS, DMSA, EDTA) vorgezogen. Chelatbildner binden im Gewebe gespeicherte Schwermetalle und führen sie der renalen Ausscheidung zu. Eine nachfolgende Multielementanalyse des Urins gibt Auskunft über die kumulative Gesamtbelastung des Organismus. Die Ausleitung wird damit gleichzeitig diagnostisch und – durch Minderung der Schwermetalllast des Patienten - kurativ genutzt.
Benötigtes Probenmaterial
2 ml EDTA-Blut bzw 10 ml Harn. Auf Anfrage schicken wir Ihnen gern Abnahmematerial zu.
Abrechnung
Die Untersuchung gehört nicht zum Leistungsspektrum der Gesetzlichen Krankenkassen (GKV). Die Kosten betragen für Selbstzahler 104,92 € (EDTA-Blut) bzw. 107,25 € (Urin). Für privat versicherte Patienten betragen die Kosten 120,66 € bzw. 123,34 €. Privatkassen übernehmen bei gegebener Indikation die Kosten ohne Probleme.
Biochemische Effekte einer Metallbelastung sind oxidativer Stress und Entzündung.
Auch wenn keine Metall-Sensibilisierung besteht, können Metallbelastungen den Organismus schädigen. Umweltmediziner können einige dieser nicht-allergischen Effekte mittels geeigneter Laborparameter untersuchen und quantifizieren:
- Metalle können eine chronische Immunaktivierung triggern. Anders als bei der Typ IV-Allergie beruht eine solche Entzündungsreaktion auf einer Aktivierung des angeborenen Immunsystems. Aussagekräftige Serumparameter sind hier die Zytokine TNF-α, Interleukin-6 und das hoch sensitive CRP als Entzündungsmarker.
- Ferner ist es eine gemeinsame Eigenschaft zahlreicher Metalle, oxidativen Stress auszulösen. Die entstehenden freien Radikale greifen zelluläre Strukturen und Makromoleküle an, wie z.B. die DNA, und bilden die Grundlagen für zahlreiche zytotoxische und mutagene Metallwirkungen. Ein zuverlässiger Laborparameter zur Quantifikation des oxidativen Stress ist das Malondialdehyd-modifizierte LDL (MDA-LDL) im Serum.
- Von großer Bedeutung für ihre Toxizität ist darüber hinaus die Interaktion von Metallen mit der Darmschleimhaut. Metalle können (aus Nahrung oder Zahnersatz) die Mukosa schädigen und so die Darmpermeabilität steigern. Eine erhöhte Durchlässigkeit der Darmwand wiederum erhöht die systemische Aufnahme von Metallen aus dem Darm. Für das „leaky gut“-Syndrom liefert das Zonulin im Serum einen guten Laborparameter.
- Ekstrand et al. Toxicological aspects on the release and systemic uptake of mercury from dental amalgam. Eur J Oral Sci. 1998;106:678-686.
- Exley. Human exposure to aluminium. 2013;15:1785-1970.
- Ganss et al. Relation between mercury concentrations in saliva, blood, and urine in subjects with amalgam restorations. Clin Oral Invest. 2000;4:206–211.
- Gump et al. Fish Consumption, Low-Level Mercury, Lipids, and Inflammatory Markers in Children. Environ Res. 2012;112:204–211.
- Hu et al. Arsenic toxicity in the human nerve cell line SK-N-SH in the presence of chromium and copper. Chemosphere. 2013;91:1082-1087.
- Järup. Hazards of heavy metal contamination. British Medical Bulletin. 2003;68:167–182.
- Jennrich. Schwermetalle. Ursache für Zivilisationskrankheiten. CO’MED Verlagsgesellschaft mbH. Hochheim. 2007.
- Wieloch et al. Do toxic heavy metals affect antioxidant defense mechanisms in humans? Ecotoxicology and Environmental Safety. 2012;78:195–205.
- Zimmer et al. Determination of mercury in blood, urine and saliva for the biological monitoring of an exposure from amalgam fillings in a group with self-reported adverse health effects. Int. J. Envirom Health. 2002;205(3):205-211.