Häufig gestellte Fragen (FAQ)
Ja – aber nur dann, wenn in den zu vergleichenden Laboren dasselbe Spektrum an Fettsäuren gemessen wird. Der Omega 3-Index berechnet sich nämlich nicht allein aus EPA und DHA, sondern als prozentualer Anteil dieser beiden Fettsäuren an allen langkettigen Fettsäuren. Vergleichbar sind die Ergebnisse des Omega 3-Index also immer dann, wenn tatsächlich das gleiche Set der langkettigen Fettsäuren gemessen wird, also die Bezugsgröße 100% identisch ist. Das am IMD gemessene Spektrum entspricht exakt den Fettsäuren, die im Rahmen der Studien zum Omega 3-Index gemessen wurden (u. a. von Schacky und Harris, 2007). Sogar bei dem kleinen Profil „Omega 3-Index“ werden für die Berechnung im Hintergrund alle diese Fettsäuren analysiert, auch wenn auf dem Laborbefund nur EPA und DHA übermittelt werden. Das zweite wichtige Kriterium für die Vergleichbarkeit ist das Untersuchungsmaterial: Der Omega 3-Index muss aus EDTA-Blut gemessen werden, weil nur die Fettsäuren der Erythrozytenmembranen Aussagen über den langfristigen Versorgungsstatus erlauben. Plasma, Serum oder Vollblut sind nicht vergleichbar. Am IMD erfolgt die Analyse der langkettigen Fettsäuren ausschließlich aus venös entnommenem EDTA-Blut. Auf der Grundlage dieser entscheidenden Merkmale – dem Fettsäurespektrum und der Analyse dieser Fettsäuren in der Erythrozytenmembran – ist der, am IMD Berlin ermittelte, Omega 3-Index mit Befunden aus Laboren vergleichbar, die nach denselben Kriterien arbeiten.

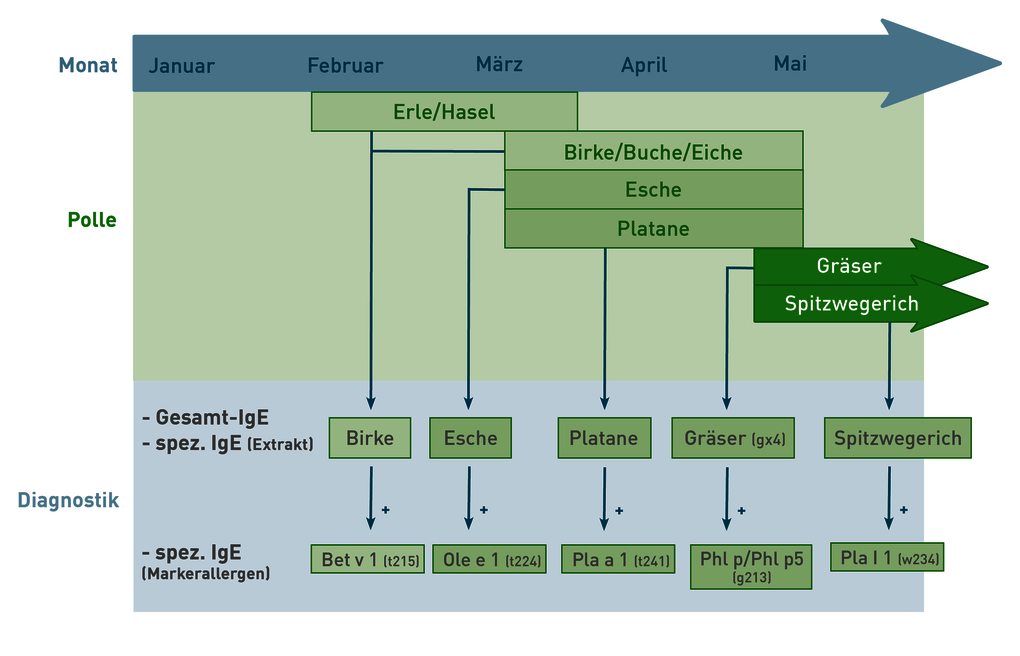
Bei Verdacht auf allergische Rhinitis oder Konjunktivitis im Frühjahr wird zur Diagnosestellung die Bestimmung von spezifischem IgE gegen potenzielle Allergene empfohlen. Gleichzeitig ist es ratsam, das Gesamt-IgE zu bestimmen, um die Ergebnisse besser interpretieren zu können. Ein Anteil an spezifischem IgE von mindestens 1% deutet in der Regel auf eine klinische Relevanz hin. Zu den Hauptauslösern gehören Baumpollen von Birken- und Buchengewächsen (wie Erle, Hasel, Birke, Buche und Eiche), deren Blütezeit bereits im Februar beginnt und bis in den Mai dauern kann. Da die Reaktion auf diese Pollen auf ein homologes Protein der PR-10 Protein-Familie zurückzuführen ist, ist die Bestimmung von spezifischem IgE gegen Birkenpollen in der Regel ausreichend. Alternativ können auch Platanen- und Eschenpollen ähnliche Symptome auslösen und sollten daher berücksichtigt werden. Die Saison der Süßgräser beginnt in der Regel Anfang Mai und umfasst Gräser wie Lieschgras, Roggen, Weizen, Gerste, Hafer und verschiedene Wiesen- und Feldgräser. Aufgrund großer Homologien zwischen diesen Gräsern reicht die Untersuchung von spezifischem IgE gegen eine Gräsermischung (gx4) oder ein repräsentatives Gras wie Lieschgras oder Roggen aus. Die Blütezeit von Spitzwegerich beginnt ebenfalls im Mai und erstreckt sich bis in den Sommer hinein. Da Pollenallergiker häufig gegen mehrere Pollen sensibilisiert sind, kann zur Erhöhung der Spezifität die zusätzliche Bestimmung von spezifischem IgE gegen bestimmte Markerallergene empfohlen werden. Ein positives Ergebnis auf diese Allergene deutet auf eine spezifische Sensibilisierung hin und kann eine Indikation für eine spezifische Immuntherapie sein (siehe Musterbefund). Zur Anforderung der Allergiediagnostik verwenden Sie bitte unseren Allergieschein (Link zum PDF).
Während der Schwangerschaft ist der Vitamin-D-Status von besonderer Bedeutung für die Gesundheit von Mutter und Kind. Unzureichende Versorgung ist ein Risikofaktor für Schwangerschaftshypertonie und -diabetes sowie für Frühgeburt, Wachstumsstörungen, niedriges Geburtsgewicht, erhöhte perinatale Mortalität und Morbidität (z. B. schlechtem APGAR-Score) und für die Entwicklung des metabolischen Syndroms im Erwachsenenalter.
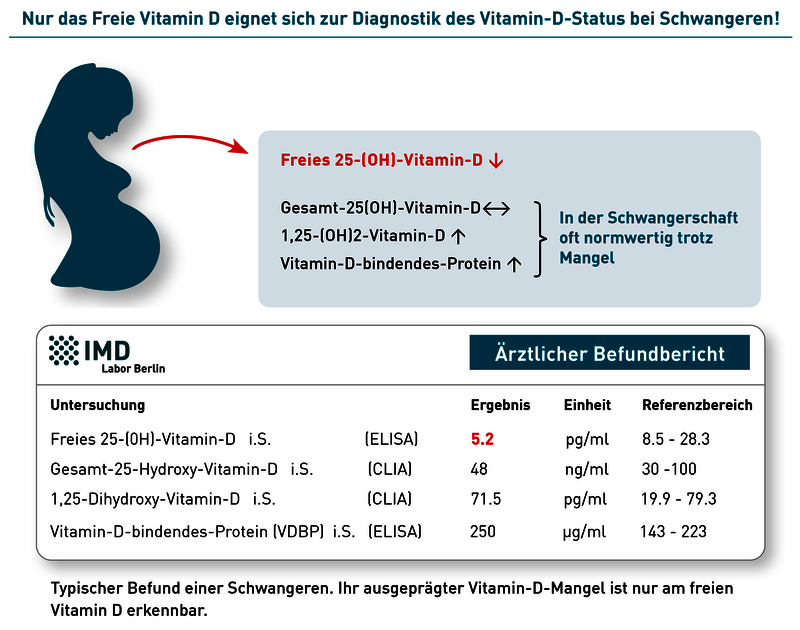
Das erforderliche Monitoring des Vitamin-D-Status erfolgt idealerweise durch Messung von freiem 25(OH)-Vitamin-D und 1,25-(OH)2-Vitamin-D vor geplanter Schwangerschaft, in der Frühschwangerschaft und im letzten Trimenon. Wichtig ist die Messung von freiem Vitamin D, da es das biologisch aktive 25(OH)-Vitamin-D widerspiegelt und dieser Messwert – anders als das Gesamt-25(OH)-Vitamin-D – in der Schwangerschaft nicht Östradiol-bedingt fälschlich eine gute Versorgung vortäuscht. Östradiol, das in der Schwangerschaft deutlich ansteigt, ist einer der stärksten Stimuli für die Synthese von Vitamin D Bindungsprotein (VDBP) in der Leber. Die VDBP-Serumkonzentration wiederum beeinflusst die Menge an Gesamt-(OH)-Vitamin-D im Blut. Gesamt-25(OH)-Vitamin-D kann daher in der Schwangerschaft Östradiol-bedingt konstant auf einem guten Niveau bleiben, auch wenn das bioverfügbare freie 25(OH)-Vitamin-D deutlich zurückgeht und eine Mangelsituation entsteht. Dieser Zusammenhang zeigt den besonderen Wert des Östradiol-unabhängigen, freien 25(OH)-Vitamin-D in der Schwangerschaft.
Eine weitere wenig beachtete Besonderheit in der Schwangerschaft ist der Anstieg von 1,25-(OH)2-Vitamin-D. Er ist auf die plazentale Expression der 1-alpha-Hydroxylase zurückzuführen, ein Enzym, das die in höheren Konzentrationen sonst nur in der Niere vorkommt. Dies hat zur Folge, dass die 1,25-(OH)2-Vitamin-D-Spiegel bei Schwangeren etwa doppelt so hoch sind wie bei Frauen, die nicht schwanger sind. In anderen Worten: Für die Allgemeinbevölkerung normwertige Vitamin-D-Parameter können bei Schwangeren mit einer Vitamin-D-Unterversorgung verbunden sein. Nur freies Vitamin D beschreibt auch bei Schwangeren zuverlässig den Vitamin D Status.
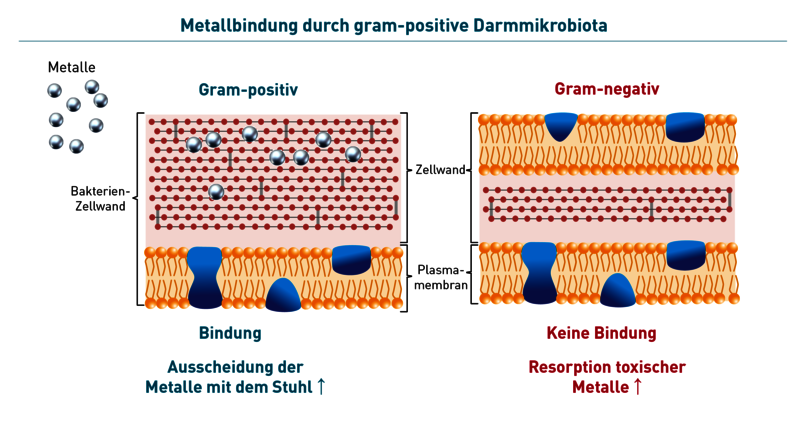
Gram-positive Bakterien binden Metalle besser als gram-negative Bakterien – sie adsorbieren sie auf ihrer Oberfläche. Ein höheres Vorkommen gram-positiver Bakterien führt daher zu einer verbesserten Metallausscheidung mit dem Stuhl. Entsprechend wird eine geringere systemische Aufnahme bei gegebener Metallexposition beobachtet. Zu den gram-positiven Bakterien gehören Bifidobakterien, Lactobazillen, Faecalibacterium prausnitzii u.v.m. (hier im Laborbefund markiert). Der Einsatz gram-positiver Probiotika zur Reduktion der Metallaufnahme wurde bereits in einzelnen kleineren Studien mit positiven Ergebnissen untersucht. Proteobakterien, wie z.B. E.coli, Shigellen und Enterobacteriaceae gehören zu den gram-negativen Bakterien, die Metalle schlechter binden und dadurch einen Vermehrungsvorteil gegenüber den gram-positiven Bakterien haben. Es kommt also nicht nur zur erhöhten Aufnahme von Metallen ins Blut, sondern auch im Darm zur Dysbiose. Durch ein Überwachsen mit Proteobakterien entstehen auch mehr toxische Metabolite dieser Bakterien. Diese Metabolite schädigen die Darmschleimhaut, was nicht selten zu einem leaky gut führt.
Oft sehen wir bei unseren Patienten nur das leaky gut oder die Dysbiose. Für eine ursachenbasierte Behandlung sollte eine Metallbelastung überprüft werden, da in diesem Fall eine gleichzeitige Unterstützung der körpereigenen Entgiftungssysteme – u.a. durch Gabe von Glutathionbausteinen, Alpha-Liponsäure und Selen – oder ausleitende Therapien hilfreich wären.
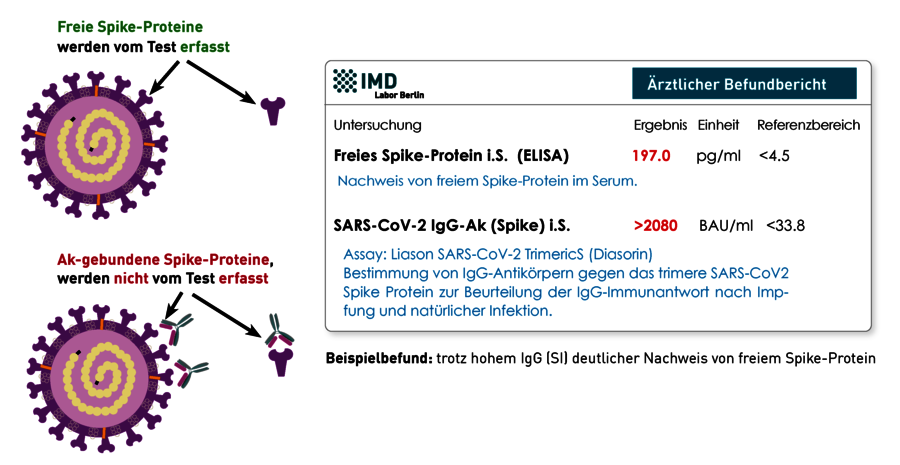
Das Spikeprotein befindet sich auf der Oberfläche des SARS-CoV-2-Virus und dient diesem zum Eintritt in eine Wirtszelle. Dabei fungiert das ACE 2 (Angiotensin Converting Enzyme 2) als Haupt-Rezeptor. Dieser Mechanismus machte das Spike-Protein zum Hauptziel der durch Impfung-induzierten anti-SARS-CoV-2-Immunität. Das Spike-Protein kann von menschlichen Zellen gebildet werden: (1) bei einer natürlichen Infektion und (2) durch das Einbringen des Bauplans über mRNA- oder DNA-basierte Impfstoffe. Das Persistienz von zirkulierenden SARS-CoV-2-Spike-Proteinen nach Impfung oder Infektion wird als einer von vielen möglichen Pathomechanismen für das Beschwerdebild des Post-COVID- bzw. Post-Vac-Syndroms diskutiert. Die Ursache der Persistenz ist bisher nicht verstanden. Spekuliert wird über ein verbleibendes Virus-Reservoir, RNA-Erhalt oder eine lange Stabilität des Proteins. Klarheit gibt es hier bislang nicht.
Das im Blut zirkulierende freie Spike-Protein kann mittels ELISA-Technik nachgewiesen werden. Da der Assay das an Antikörper gebundene Spike-Protein nicht erkennt, schließt ein negatives Ergebnis seine Anwesenheit im Patienten nicht zwangsweise aus. Allerdings kann man davon ausgehen, dass gebundenes Spike-Protein nicht an die entsprechenden Ziel-Rezeptoren binden kann und daher keine Wirkung hat. Doch auch hohe S1-IgG-Ak-Titer schließen ein Vorkommen von freiem Spike-Protein nicht aus. Zur Einschätzung der Bindungsfähigkeit der Antikörper kann die Messung der S1-IgG-Ak und ihrer Neutralisationskapazität hilfreich sein.
Derzeit ist es noch nicht möglich, „Impf-Spike-Protein“ von Virus-Spike-Protein zu unterscheiden und somit den Ursprung des persistierenden Proteins zu erfassen, Impfung oder Infektion. Ebenso kann das Spike-Protein bisher nicht den unterschiedlichen SARS-CoV-2-Varianten zugeordnet werden.
Zusammengefasst spricht der Nachweis von freiem Spike für eine Persistenz des Proteins, sofern es nicht während der akuten SARS-CoV-2-Infektion bzw. unmittelbar nach Impfung gemessen wird. Eine Beteiligung des Spike-Proteins an der Pathologie von Post-COVID-bzw. Post-Vac-Syndrom wird angenommen, ist aber bisher nicht bewiesen. Daher ist ein positives Ergebnis immer mit der Klinik (Symptomatik) abzugleichen und letztere ausschlaggebend.
Zur Anforderung dieser Analytik, sowie des IgG (S1) und der Neutralisationskapazität verwenden Sie bitte unseren COVID19-Anforderungsschein (Link zum PDF).
Nein – das ist der Unterschied zum LTT! Der Elispot ist ein sehr gutes und extrem sensitives Laborverfahren, um einen irgendwann stattgefundenen Kontakt zu einem Erreger zu belegen. Deshalb ist er Goldstandard beim Nachweis einer zurückliegenden Tuberkuloseinfektion, unabhängig davon, ob diese aktuell aktiv und behandlungsbedürftig ist oder nicht. Ganz ähnlich wurde auch für Borrelien gezeigt, dass der Elispot nicht zwischen symptomatischen und asymptomatischen Verläufen differenzieren kann. Beide Verfahren wurden in klinischen Studien getestet: Nicht weniger als 10 Publikationen zeigen, dass mit dem LTT eine Differenzierung zwischen aktiver und ausgeheilter Borreliose bzw. Gesunden möglich ist. In 5 der 6 Studien mit Verlaufskontrolle nach Antibiose fiel der LTT nach der Behandlung signifikant ab. Zum Elispot-Test bei Borreliose sind bis heute 9 Patientenstudien publiziert, die im Wesentlichen aussagen, dass der Elispot zwar einen stattgefundenen Kontakt mit Borrelien, d.h. eine Gedächtniszellantwort, mit hoher Sensitivität nachweist, aber keine Differenzierung zwischen aktiver Borreliose und ausgeheilter Erkrankung erlaubt. Da der Elispot häufig auch nach Ausheilung oder antibiotischer Therapie dauerhaft positiv bleibt, dient er im Unterschied zum LTT nicht dazu, die Indikation für eine antibiotische Therapie zu stellen. Einen Überblick über die aktuelle Studienlage zu beiden Tests haben Frau Dr. Hopf-Seidel und Dr. Volker von Baehr kürzlich in der UMG veröffentlicht. Sie finden den Artikel
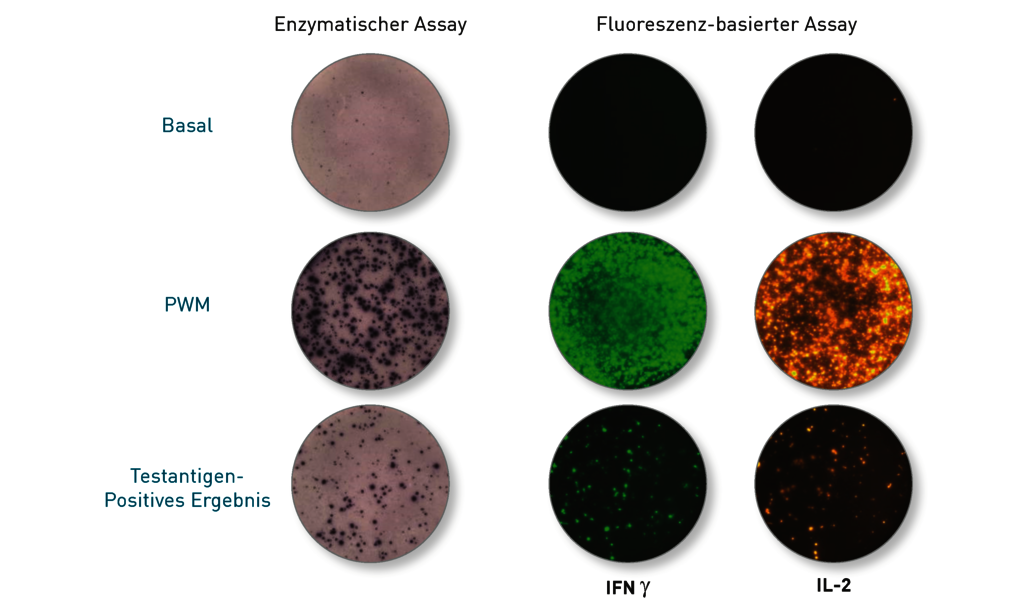
Die Abbildung zeigt die Ergebnisse des Elispot (Enzymatisch und Fluoreszenz-basiert) in der Negativ- und Positivkontrolle (Reihe 1 und 2) und nach Stimulation mit M. tuberkulosis-spezifischen Peptiden (untere Reihe). Hier erkennt man farblich und fluoreszenz-angefärbte Zytokin-positive Gedächtnis-T-Zellen, die eine Immunität widerspiegeln (auch wenn diese bekanntlich bei Borrelien wegen der Diversität der Erregerstämme nicht vor Neuinfektionen schützt).
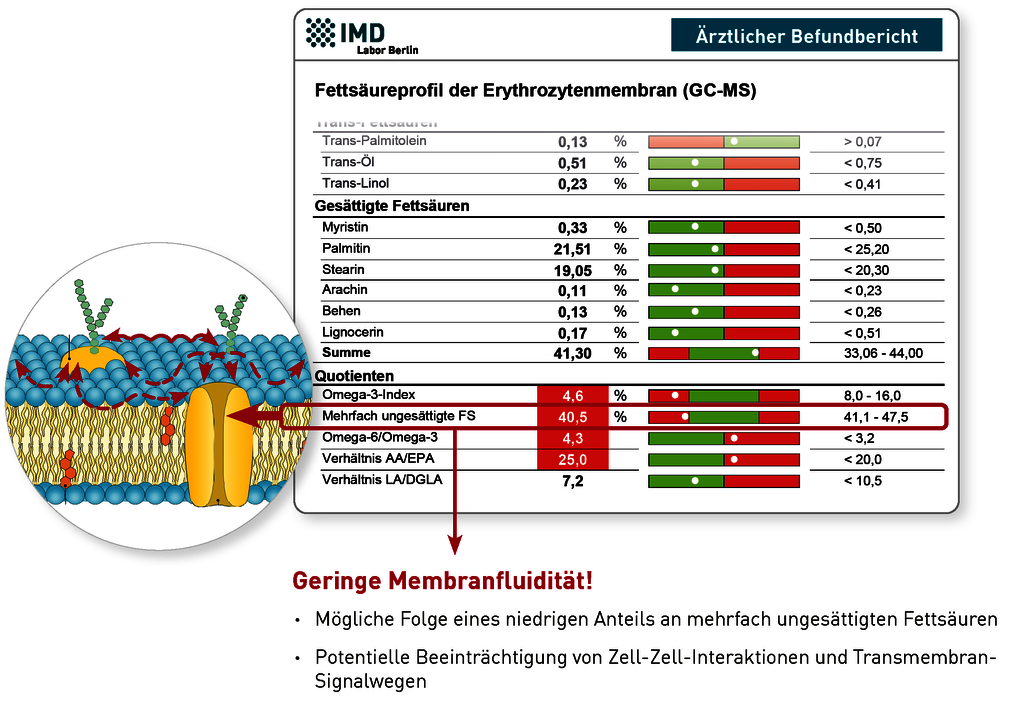
Zellmembranen sind keine starren, undurchlässigen Hüllen, sondern funktionelle Einheiten, die Austausch und Kommunikation zwischen dem Zellinnerem und dem Extrazellularraum regulieren. Wichtige Voraussetzung für diese Regulationsfähigkeit ist ihre adäquate „Fluidität“, d.h. die Flexibilität der Membran und die Beweglichkeit ihrer Komponenten. Die Fettsäurezusammensetzung der Membran hat einen wesentlichen Einfluss auf ihre Fluidität: Sie wird durch einen hohen Anteil mehrfach ungesättigter Fettsäuren gesteigert und durch einen niedrigen Anteil gesenkt. Wichtig ist zu beachten, dass sowohl eine stark herabgesetzte als auch eine gesteigerte Fluidität die Funktion der Zellmembranen beeinträchtigt, mit meist unspezifischen Auswirkungen auf nahezu alle Organe und physiologischen Funktionseinheiten, wie z.B. neurologische Funktionen, Integrität von Epithelien und die Regulationsfähigkeit des Immunsystems. Ein adäquater Anteil mehrfach ungesättigter Fettsäuren, also sowohl Omega 3- als auch Omega 6-Fettsäuren, in den Zellmembranen ist somit von grundlegender Bedeutung für viele Stoffwechselwege. Er wird daher auf dem Laborbefund extra ausgewiesen (siehe Abbildung).
Auffällige „Leberwerte“, kann es sich um eine Autoimmunerkrankung handeln?
Ja durchaus. Veränderte Leberwerte sollten zügig abgeklärt werden, da sie eine Schädigung der Leberzellen anzeigen. Zu diesen Werten zählen z.B. bestimmte Enzyme, die dann ansteigen, wie GOT, GPT, GGT und AP. Nach Abklärung häufiger Ursachen für eine Leberentzündung, wie z.B. Fettleber (durch Übergewicht, Diabetes mellitus, Alkohol) oder Virusinfektionen, sollte auch an die Eisenspeicherkrankheit Hämochromatose und eben an autoimmune Lebererkrankungen gedacht werden. Autoimmun bedingte Entzündungen der Leber oder Gallengänge sollen lt. der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) bis zu 20% der Fälle ausmachen. Zu den 3 Hauptformen der autoimmunen Lebererkrankungen zählen die Autoimmunhepatitis (AIH), die primär-biliäre Cholangitis (PBC) und die primär-sklerosierende Cholangitis (PCS). Da diese Erkrankungen über lange Zeit symptomlos bleiben oder nur unspezifische Symptome wie z.B. Müdigkeit und Juckreiz zeigen, wird eine Diagnose leider oft erst im fortgeschrittenen Stadium gestellt. Das kann sich allerdings ungünstig auf den Verlauf und die Prognose auswirken. Essentiell für eine Diagnose und Differenzierung ist neben der klinischen Symptomatik die Bestimmung spezifischer Autoantikörper (AAk). Leitliniengerecht sollten neben den quantitativen Immunglobulinen (IgG, IgM, IgA) vor allem folgende AAk untersucht werden: ANA (anti-nukleäre Ak), ASMA (AAk gegen glatte Muskulatur)/Aktin-AAk, LKM-AAk (anti-Leber-Nieren-Mikrosomen-Ak), AMA (anti-Mitochondrien-Ak), SLA/LP-AAk (lösliches Leberantigen-AAk) und pANCA (anti-neutrophile zytoplasmatische Ak). Die entsprechende klinische Zuordnung der AAk sieht folgendermaßen aus:
- AIH wird abhängig vom AAk-Profil in zwei Subformen unterschieden: AIH Typ 1 → ANA, ASMA/Aktin-AAk oder SLA/LP-AAk; AIH Typ 2 → LKM-AAk, LC1-AAk
- PBC: Diagnostisch wegweisend sind AMA (M2-AMA) und bestimmte ANA-Fluoreszenzmuster („mehrere nukleäre Punkte“, „nukleär randständig (Kernmembran)“ oder „Zentromere“)
- PSC: Einen wertvollen Anhaltspunkt liefern die pANCA, es gibt jedoch keine spezifischen serologischen Marker.
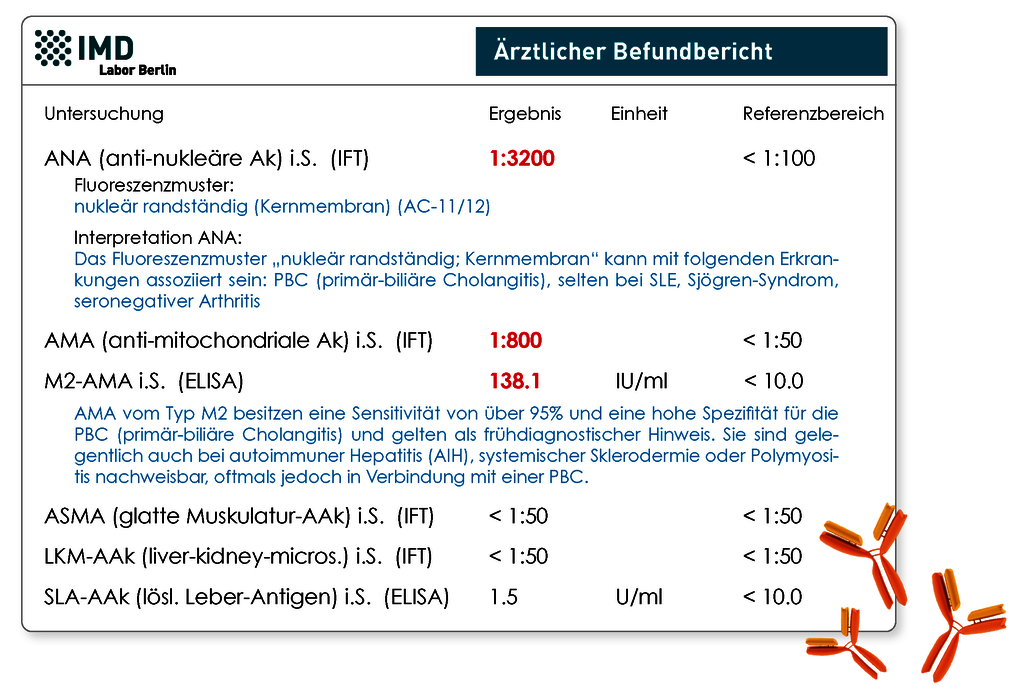
Abb.: Beispielbefund mit serologischem Hinweis auf eine primär-biliäre Cholangitis (PBC)
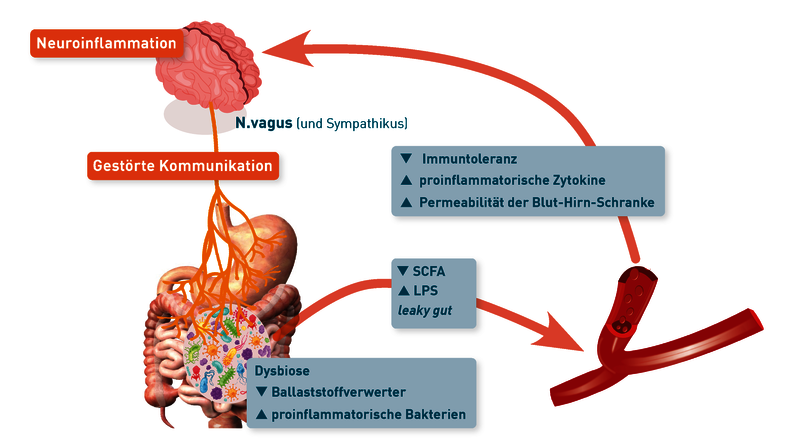
Nach aktuellem Stand der Forschung ist die Antwort „Ja“, denn Darmbakterien beeinflussen direkt die Ausschüttung von Signalmolekülen, die über die Darm-HirnAchse mit dem zentralen Nervensystem kommunizieren. Dies geschieht z.B. über Lipopolysaccharide aus der Zellwand der Proteobacteria, die proinflammatorische Zytokine induzieren, und über neuroaktive bakterielle Stoffwechselprodukte wie kurzkettige Fettsäuren (SCFA), Metabolite des Tryptophanstoffwechsels oder sekundäre Gallensäuren. Studien belegen, dass Veränderungen der bakteriellen Zusammensetzung im Darm (Dysbiose) die Wechselwirkungen mit dem ZNS stören und Gehirnfunktionen und Verhaltensweisen, einschließlich Stimmung, Gedächtnis und Schmerzempfinden, beeinflussen. Eine Dysbiose kann außerdem Entzündungen der Darmschleimhaut und eine erhöhte Permeabilität der Darmbarriere verursachen. Dadurch gelangen u.a. bakterielle Bestandteile und Stoffwechselprodukte vermehrt in den systemischen Kreislauf und können eine dauerhafte Aktivierung des Immunsystems und systemische Entzündungsreaktionen auslösen oder verstärken. Die Modulation der Darmmikrobiota und ihrer Metabolite rückt daher als vielversprechender Ansatz zur Beeinflussung neuroimmunologischer Erkrankungen (z.B. der multiplen Sklerose) in den Fokus. Eine gesunde Ernährung, Prä- und Probiotika können dazu beitragen, die Balance der Darmmikrobiota und der Immunregulation aufrechtzuerhalten. Um den aktuellen Zustand des Darmmikrobioms, der Darmschleimhaut und ihrer Barrierefunktion zu beurteilen, liefern Mikrobiomanalysen, Stuhlparameter für Entzündung und leaky gut (Calprotectin, Alpha-1-Antitrypsin, Zonulin) sowie die kurzkettigen Fettsäuren in Stuhl und Serum wichtige Hinweise (siehe Anforderungsschein Mikrobiomdiagnostik, Link zum PDF).
Bei Untersuchungen des Vitamin-B12-Status kommt es vor, dass der Laborbefund einen deutlich erhöhten Wert zeigt, der sich nicht durch eine Substitution erklären lässt. In diesem Fällen sollten folgende Erklärungsmöglichkeiten beachtet werden:
• Der Test könnte zeitlich zu nah nach der Einnahme von Vitamin-B12-Präparaten durchgeführt worden sein. Empfohlen sind 7-10 Tage Karenzzeit zwischen Substitution (Injektion oder oral) und der Blutentnahme.
• Die Vitamin-B12-Konzentrationsmessung könnte durch IgG-IgM-Vitamin-B12-Immunkomplexe sowie Autoantikörper gegen den Intrinsic-Faktor gestört worden sein. Dies kann vermieden werden, wenn der bioaktive Vitamin-B12-Assay verwendet wird, da er von diesen Faktoren nicht beeinflusst wird.
• Es liegt eine Erkrankung vor, die die Produktion von Haptocorrinen /Transcobalaminen steigert, z.B.:
- Lebererkrankungen (Hepatitis, Leberzirrhose, alkoholische Leber)
- Tumorerkrankungen (Leber, Brust, Darm, Magen, Bauchspeicheldrüse)
- Blutkrankheiten (CML, Polycythaemia vera, Myelofibrose, Hypereosinophiles Syndrom, akute Leukämie)
• In geringerem Ausmaß führt auch eine Retention der Transportproteine, z.B. bei Nierenerkrankungen, zu erhöhten B12-Werten.
• Es liegt eine Verwertungsstörung vor, d.h. es ist nicht genügend Transcobalamin II-gebundenes Vitamin B12 (HoloTC) verfügbar. Hier empfiehlt sich die Messung des HoloTC.
• Bei Darmerkrankungen kann es ebenfalls durch bakterielle Überwucherung im Darm zu erhöhter Produktion von Vitamin-B12-Analoga durch Bakterien kommen.
Wir empfehlen folgendes Vorgehen:
- Messung kontrollieren, ggf. unter Beachtung der Karenzzeit und über das bioaktive Vitamin B12, wie oben beschrieben.
- Physiologische Vitamin-B12-Schwankungen sind wahrscheinlich ohne klinische Relevanz.
- Persistierende Vitamin-B12-Erhöhungen sind abzuklären, da sie auf schwerwiegende Erkrankungen hinweisen können (siehe oben).

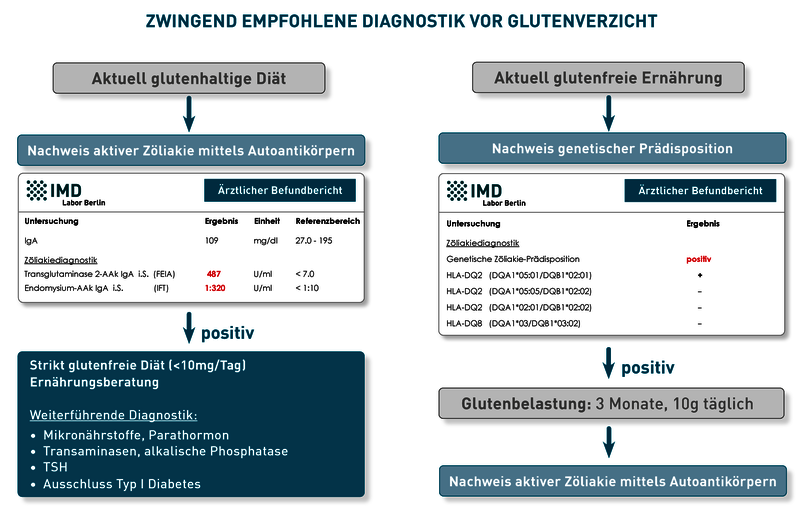
Da bei Zöliakie bereits der Verzehr kleinster Mengen Gluten zu einer Schädigung der Darmschleimhaut führt und das Risiko für Spätfolgen wie z.B. Infertilität, Osteoporose, Ataxie, Neuropathie, Nephropathie, Hepatitis und Myalgien steigert, müssen sich Betroffene lebenslang glutenfrei ernähren. Als unbedenklich gilt ein Schwellenwert von 10 mg Gluten/Tag, was ca. 10 Brotkrümeln oder 1/3 eines Brotcroutons entspricht. Doch selbst glutenfreie Produkte sind nicht gänzlich frei von Gluten: In Europa gilt ein Erzeugnis als „glutenfrei“, wenn es weniger als 0,02% bzw. 20 mg/kg Gluten enthält. Somit kann der Verzehr von 250g glutenfreiem Brot zum Frühstück und 250g glutenfreier Pasta zum Mittagessen bereits den Schwellenwert erreichen. Die notwendige strikt glutenfreie Diät bedeutet daher für Patienten und Angehörige einen hohen Aufwand und eine Einschränkung der Lebensqualität.
Patienten, die unter Glutensensitivität leiden oder Gluten aus anderen Gründen schlecht vertragen, sind bezüglich ihrer Glutenkarenz weniger strengen und starren Regeln unterworfen. Eine differentialdiagnostische Abgrenzung zur Zöliakie ist daher sehr wichtig, kann jedoch nur unter glutenhaltiger Kost erfolgen (Diagnostik-Schema: siehe Abbildung). Ein detaillierter Vorschlag zur Labordiagnostik bei Verdacht auf Weizenunverträglichkeit kann auch unsere neuen Diagnosekarte (Link zum PDF) entnommen werden (als Karte bestellbar über SI.Service@IMD-Berlin.de).
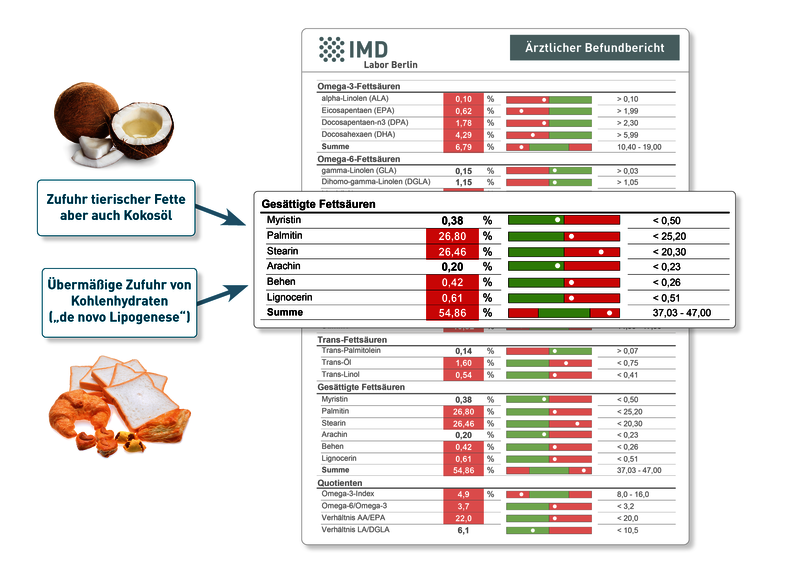
Da tierische Fette viele gesättigte Fettsäuren enthalten, mögen erhöhte Werte bei veganer Ernährung auf den ersten Blick unplausibel erscheinen. Doch es gibt zwei wesentliche Quellen, aus denen ein solcher Anstieg auch bei Veganern resultieren kann:
- Gesättigte Fettsäuren kommen auch in pflanzlichen Fetten und Ölen vor. Kokosöl z.B. ist ein in der veganen Ernährung häufig verwendetes Fett, das überwiegend gesättigte Fettsäuren enthält. Auch das in prozessierten Lebensmitteln viel verwendete pflanzliche Palmöl besteht zu 50% aus gesättigten Fettsäuren.
- Darüber hinaus kann auch eine übermäßige Zufuhr von Kohlenhydraten bewirken, dass der Anteil gesättigter Fettsäuren in der Erythrozytenmembran ansteigt. Der zugrunde liegende Vorgang wird als „de novo Lipogenese“ bezeichnet: Wie andere Säugetiere auch wandelt der Mensch überschüssige Energie in gesättigte Fettsäuren um.
Da erhöhte Anteile gesättigter Fettsäuren entzündungsfördernd und Herz-Kreislauf-schädigend wirken und die Membraneigenschaften ungünstig beeinflussen, sollten sie bei der Interpretation des Fettsäurestatus besondere Beachtung finden.
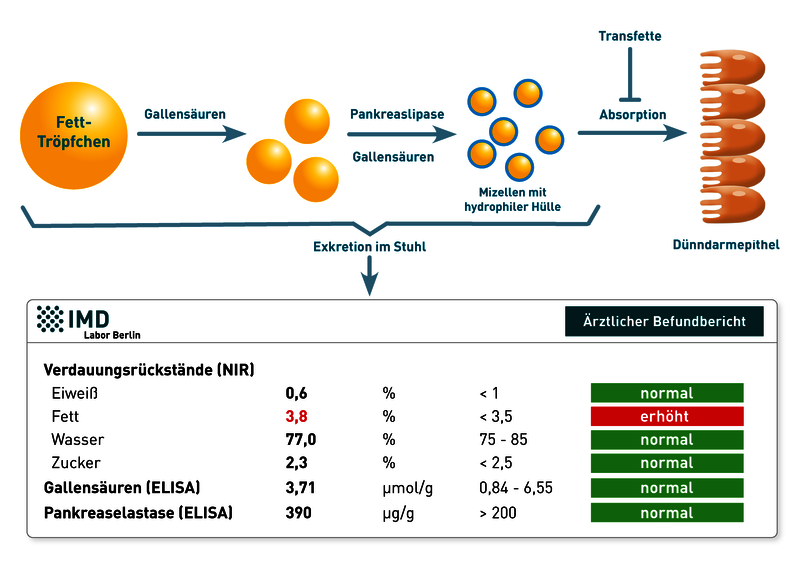
Bei der Analyse von Verdauungsrückständen im Rahmen der Stuhldiagnostik ist ein erhöhter Fettanteil in der Regel auf zwei mögliche Ursachen zurückzuführen
(1) Störung der Fettverdauung:
- Eine ungenügende Produktion von Verdauungsenzymen durch die Bauchspeicheldrüse (exokrine Pankreasinsuffizienz) führt zu einem Mangel an Pankreas-Lipase, dem wichtigsten Abbauenzym von Fetten im Dünndarm. Die Folge ist eine unvollständige Fettaufspaltung und Resorption. Die diagnostische Abklärung ist über die PankreasElastase im Stuhl möglich. Dieser Marker wird im Gegensatz zu anderen Pankreasenzymen nicht im Darm abgebaut und kann daher als Parameter für die exokrine Pankreas-Funktion genutzt werden.
- Ein Mangel an Gallensäuren beeinträchtigt die Emulgierung von Fetten und damit die Bildung der vom Darmepithel absorbierten Mizellen aus Gallensäuren, Fettsäuren, Lipiden und fettlöslichen Vitaminen. Auch die Effizienz der Pankreas-Lipase sinkt, da bei verminderter Mizellenbildung die Oberfläche der zu verdauenden Fetttropfen im Darm insgesamt verkleinert ist und das Enzym dadurch weniger Angriffsfläche hat. Charakteristisch für diese Störung der Fettverdauung sind niedrige Werte für Gallensäuren im Stuhl.
(2) Ernährungsfehler
- Ist wie im unten gezeigten Befundbeispiel der Fettanteil im Stuhl erhöht, während Pankreas-Elastase und Gallensäuren im Normbereich liegen, weist diese Konstellation auf Ernährungsfehler hin, wie z.B. einen erhöhten Fettanteil der Ernährung. Auch erhöhte Zufuhr von Transfetten (enthalten in hoch-verarbeiteten Produkten wie Fertiggerichten, Chips oder Backwaren) kann die Absorption von Fetten inhibieren und somit zu einer höheren Exkretion von Fett führen. Um Ernährungsfehler erkennen zu können, sollten Patienten in den Tagen vor der Analyse ihren üblichen Ernährungsgewohnheiten folgen.
Unabhängig von der Ursache, sollte unbedingt beachtet werden, dass eine weniger effiziente Verdauung und Resorption von Fetten im Dünndarm eine verminderte Aufnahme der fettlöslichen Vitamine A, D, E und K nach sich zieht.
Das Kernstück eines pharmakogenetischen Befundes ist die Zuweisung des Metabolisierer-Status, den der Patient für das untersuchte Gen trägt. Es gibt langsame, intermediäre, normale und ultraschnelle Metabolisierer. Sie setzen das in Frage stehende Medikament mit der entsprechenden Kinetik um. Es ist üblich, den Metabolisierer-Status mit seinem Akronym abzukürzen, z.B. „IM“ für einen intermediären – und damit leicht beeinträchtigten – Metabolisierer (siehe Tabelle und Befundbeispiel). Der Metabolisierer-Status leitet sich ab
- Vom Genotyp des Patienten, also dem Ergebnis der Laboruntersuchung. Die ermittelte Genvariante auf einem Chromosom (das „Allel“) wird mit einem *-Symbol und einer Nummer bezeichnet. Die Normalvariante wird allgemein als *1-Allel benannt.
- Von der wissenschaftlichen Datenlage, die für den Patienten-Genotyp bekannt ist.
Diese Befundstruktur veranschaulicht das unten aufgeführte Beispiel einer Irinotecan-Pharmakogenetik. Hier wurde im UGT1A1-Gen das *6-Allel nachgewiesen, das Studien mit einer reduzierten Enzymaktivität assoziieren. Vom anderen Elternteil ererbt liegt bei diesem Patienten ein normales *1-Allel vor. Das aktivitätsreduzierende *28-Allel ist nicht vorhanden. Die ermittelte Genkonstellation klassifiziert den Patienten damit als einen Intermediär-Metabolisierer (IM), der insgesamt über eine leicht reduzierte UGT1A1-Aktivität verfügt. Nach aktueller Empfehlung des BfARMs sollten Intermediär-Metabolisierer eine Irinotecan-Therapie mit der regulären Initialdosis beginnen. Weitere Informationen zur Irinotecan-Pharmakogenetik finden Sie in unserer neuen Diagnostik-Information (Link zum PDF).

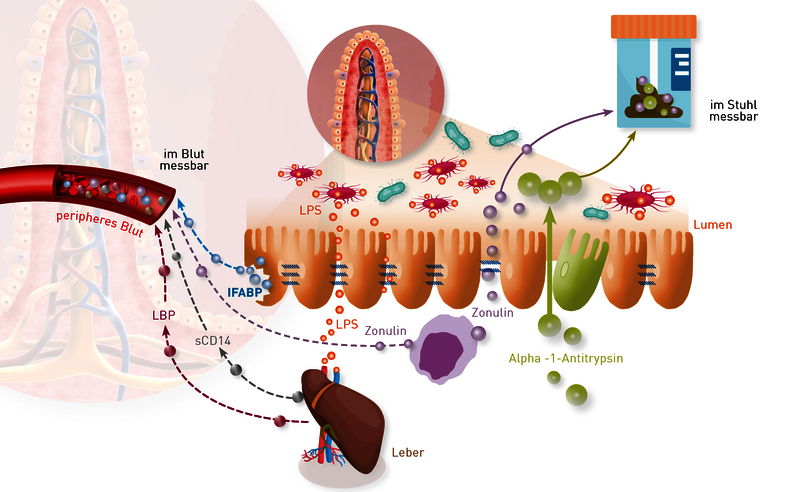
Für den Nachweis einer gestörten Darmbarriere („leaky gut“) stehen mehrere Labormarker zur Verfügung, die sich nach unseren Erfahrungen leider oft widersprechen und nicht parallel ansteigen. Einen stereotypen Laborbefund des leaky-gut-Syndroms gibt es nicht. Die unterschiedlichen Laborbefundkonstellationen beruhen auf unterschiedlichen klinischen Manifestationen und der Heterogenität der damit einhergehenden Darmepithelschädigungen. Auch mit Hinblick auf die unterschiedliche Physiologie der verschiedenen Darm-abschnitte gibt es nicht das eine klinische Bild des leaky-gut-Syndroms.
Was sind gebräuchliche leaky-gut-Parameter? Wir haben für Sie die relevanten Serum- und Stuhlparameter und ihre Bedeutung zusammengestellt (Link zur Übersicht).
Die verlinkte Übersicht über die Laborparameter zeigt klar: leaky gut ist nur durch parallele Serum- und Stuhlanalyse sicher nachzuweisen. Aufgrund der unterschiedlichen Physiologie, der Abhängigkeit einer Induktion vom leaky-gut-Auslöser (wie Entzündung, toxische Einflüsse, vegetativer Stress) und Morbiditätsfaktoren (proinflammatorische Dysbiose, Leberfunktion u.ä.), ist bei Diskrepanzen immer der auffälligere Marker ausschlaggebend. Die dringend notwendige Evaluation der genannten Marker und die Erarbeitung diagnostischer Empfehlungen bei verschiedenen Krankheitsbildern auch in Abhängigkeit von anderen Labormarkern (proinflammatorische Dysbiose? Erhöhung von Darm- und systemischen Entzündungsmarkern? Leberfunktion?) ist Gegenstand aktueller Untersuchungen am IMD Berlin.
Nein. Die bei diesem Krankheitsbild auftretenden Autoantikörper (AAk) sind nicht Ausdruck einer organspezifischen pathologischen Immunreaktion, wie z.B. TPO-AAk bei der Hashimoto-Thyreoiditis oder Leber-AAk bei der Autoimmunhepatitis. Vielmehr treten sie – häufig passager – im Rahmen systemischer Entzündung und gestörter Immuntoleranz in Folge der Infektion (oder auch der Impfung) auf. Bei Post-COVID ist bei einem signifikanten Anteil der Patienten eine Persistenz von unterschiedlichen AAk zu beobachten. Gemäß aktueller Empfehlungen sollten symptomorientiert bestimmte Autoimmunerkrankungen ausgeschlossen werden. Das betrifft die Analyse von AAk gegen Zellkernbestandteile (ENA, dsDNA), ACLA, ß2-GPI, MPO, PR3, Tg und TPO. Darüber hinaus empfehlen wir die Untersuchung der Antikörper gegen so genannte G-Protein-gekoppelte Rezeptoren (GPCR). GPCR-AAk wurden mit zahlreichen Erkrankungen des kardiovaskulären, pulmonalen und zentralen Nervensystems sowie mit Autoimmunerkrankungen in Verbindung gebracht und könnten auch bei der Pathogenese der Post-COVID-Symptome kausal von Bedeutung sein.
Richtig ist, dass die Auslösung von Autoimmunität und die Bildung von Autoantikörpern nach einer akuten Virusinfektion zu den führenden Hypothesen der Immun-Pathophysiologie des Post-COVID-Syndroms zählen. Daher haben sie Bedeutung für die Diagnosestellung und Differentialdiagnostik. Da sie aber nicht spezifisch sind, lässt sich dieses Krankheitsbild damit nicht zweifelsfrei beweisen.
Abkürzungen: ENA (extrahierbare nukleäre Antigene), dsDNA (Doppelstrang-DNA), ACLA (Cardipolipine), ß2-GPI (ß2-Glykoprotein I), MPO (Myeloperoxidase), PR3 (Proteinase 3), Tg (Thyreoglobulin), TPO (Thyreoperoxidase), GPCR (G-Protein-gekoppelte Rezeptoren).
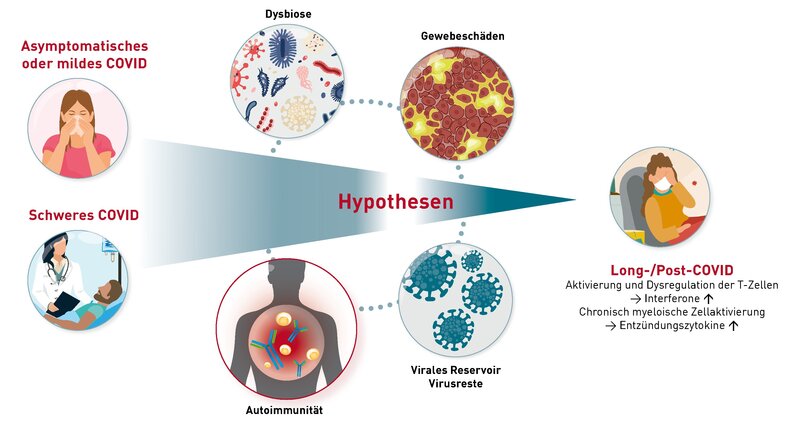
Beeinflusst die Einnahme von Anti-Allergika Provokationstests in der Allergiediagnostik?
Provokationstests sind diagnostische Hilfsmittel zur Evaluierung einer Allergie und ihrer Ausprägung. Dabei soll die mögliche Reaktion auf ein Allergen nachgestellt werden, in vivo oder in vitro. Für die Typ-I-Allergie kommen hierzu der Pricktest (in vivo) oder der Basophilenaktivierungstest (BAT; in vitro) zum Einsatz; für die Typ-IV-Allergie der Epikutantest (in vivo) oder der Lymphozytentransformationstest (LTT; in vitro). Nicht selten stehen Patienten zum Zeitpunkt der Provokation unter Medikation mit Anti-Allergika, und es stellt sich daher die Frage nach einer möglichen Beeinflussung der Provokationstests:
- Bei Typ-I-Allergien werden häufig Anti-Histaminika wie Cetirizin oder Desloratadin angewendet. Sie blockieren Histaminrezeptoren an den Zielzellen und somit die Wirkung des Histamins, nicht aber seine Freisetzung. Das bedeutet, dass Antihistaminika weder die Histaminkonzentration im Blut noch das Ergebnis des BAT verändern, denn letzterer quantifiziert die Allergen-induzierte Freisetzung von Histamin und Leukotrienen aus Basophilen Granulozyten. Auf diesen Vorgang hat die Blockade der Histaminrezeptoren keinen Einfluss. Haut-basierte in vivo-Provokationstests für die Typ-I-Allergie, wie der Pricktest, detektieren hingegen die durch Histamin ausgelöste Hautreaktion (Quaddelbildung, Juckreiz, Rötung). Diese Histaminwirkung wird durch Anti-Histaminika deutlich beeinträchtigt. Ein Absetzen des Medikamentes mindestens 48h vor in-vivo-Testung ist somit angeraten.
- Eine weitere Wirkstoffgruppe der Antiallergika bilden Mastzellstabilisatoren wie Ketotifen. Diese hemmen die Ausschüttung von Typ-I-Mediatoren aus den Mastzellen. Topisch eingesetzte Mittel z.B. als Augentropfen, haben wenig bis gar keinen Einfluss auf den Pricktest oder den BAT. Allerdings ist die Sensitivität des Pricktests bei systemischer Einnahme durchaus vermindert. Je nach Dosis können zusätzlich auch die Basophilen Granulozyten beeinträchtigt sein und demnach die Aussagekraft des BAT.
- Provokationstest für die Typ-IV-Allergie, wie der LTT oder Epikutanstest, sind gänzlich unabhängig von Typ-I-Mediatoren, da hier Allergen-spezifische T-Zellen nachgewiesen werden.
- Glukokortikosteroide hingegen wirken unspezifisch immunsuppressiv und blockieren die Funktion vieler verschiedener Immunzellen, wodurch eine Beeinträchtigung der Sensitivität aller Provokationstests in Abhängigkeit der eingenommenen Dosis zu beobachten ist.
Die kurzkettige Fettsäure Butyrat spielt als Nährstoff der Darmepithelzellen eine wichtige Rolle für die Gesunderhaltung der Darmschleimhaut. Butyrat wird im Darm von bestimmten Bakterien (Butyratbildner, z.B. F. prausnitzii) gebildet. Ihr Stoffwechsel und damit die Butyratproduktion wird durch Metabolite anderer Bakterien des Darmmikrobioms (u.a. Bifidobakterien) mitbestimmt. Zusätzlich werden Butyrat und andere kurzkettige Fettsäuren mit der Nahrung aufgenommen. Aufgrund dieser verschiedenen Quellen und Einflüsse besteht zwar eine gewisse Korrelation zwischen dem Vorkommen butyratbildender Bakterien und der Butyratkonzentration im Stuhl, für eine Beurteilung der Nährstoffversorgung des Darmepithels sind jedoch beide Parameter erforderlich:
- „Butyrat im Stuhl“ quantifiziert die Menge an Butyrat, die den Epithelzellen zur Aufnahme zur Verfügung steht. Hier bestehen deutliche Unterschiede zwischen Patienten, auch wenn Butyratbildner vorhanden sind.
- „Butyratbildende Bakterien im Stuhl“ zeigen die Kapazität des Mikrobioms an, selbst Butyrat zu produzieren und damit die Versorgung kontinuierlich zu sichern.
- Eine geringe Butyratkonzentration bei normalen Mengen von Butyratbildnern weist auf eine Hemmung des Stoffwechsels dieser Bakterien hin, z.B. durch Wechselwirkungen innerhalb des Mikrobioms. Eine typische Ursache wäre ein Mangel an Bifidobakterien oder A. muciniphila.
- Reduzierte Butyratbildner bei normaler Butyratkonzentration deuten auf eine hohe Zufuhr hin (z.B. mit Butter, fermentierten Lebensmitteln, oder unter Substitution). Um eine dauerhaft gute Versorgung zu erreichen, sollten Butyratbildner durch geeignete Prä- und Probiotika vermehrt werden.

Das IMD untersucht butyratbildende Bakterien im molekulargenetischen Mikrobiotaprofil (hier als Ausschnitt gezeigt) sowie den Hauptvertreter F. prausnitzii über quantitative PCR im Profil „Mucin-/Butyratbildung“ sowie ab sofort auch die kurzkettigen Fettsäuren Acetat, Propionat und Butyrat im Stuhl.
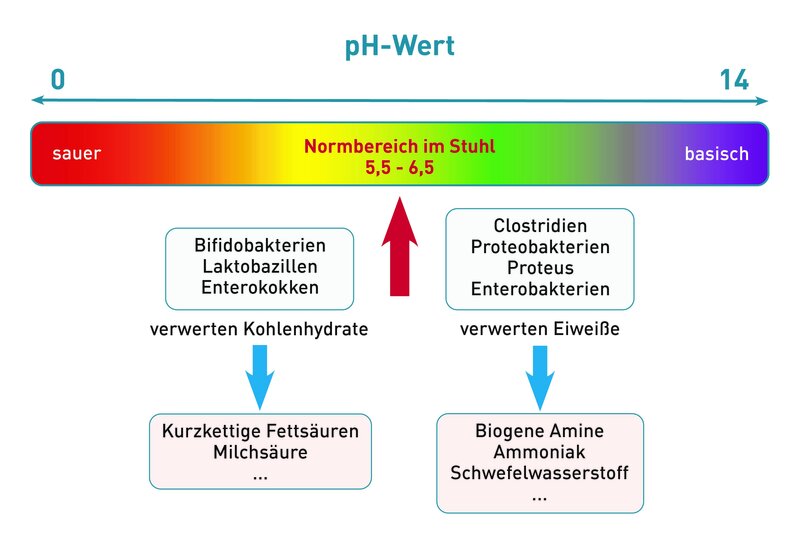
Basische Lebensmittel sind nicht per se „basisch“, ebenso ist der pH-Wert säurebildender Lebensmittel nicht immer niedrig. Vielmehr ist die Umsetzung der Nahrung durch den Stoffwechsel und die daraus entstehenden Produkte und ihre Wirkung auf das Säure-Basen-Gleichgewicht entscheidend. Einen einheitlicher pH-Wert in allen Körperregionen gibt es nicht und darf es auch nicht geben – im Gegenteil sollten bestimmte Regionen aus physiologischen Gründen eher ein basisches (z.B. Teile des Dünndarms) oder ein saures (Dickdarm) Milieu aufweisen. Um das zu erreichen, ist eine ballaststoffreiche, ausgewogene und abwechslungsreiche Ernährung, die Meidung von stark verarbeiteten Lebensmitteln und Fast-Food essentiell. Tierische Produkte sollten nicht Hauptbestandteil des Speiseplans sein. Im Rahmen der Mikrobiomdiagnostik ermitteln wir den pH-Wert des Stuhls, also des Dickdarms. Dieser sollte idealerweise zwischen 5,5 und 6,5 (also schwach sauer) sein. Ein saurer pH-Wert im Dickdarm inhibiert das Wachstum vieler nicht-säuretoleranter Bakterien, zu denen die meisten pathogenen Erreger gehören. Dagegen deutet ein neutraler oder sogar basischer pH-Wert (> 6,5) auf ein Ungleichgewicht der Darmflora (Dysbiose) hin. Er entsteht durch basische Stoffwechselprodukte (biogene Amine, Ammoniak, Schwefelwasserstoff), die insbesondere durch Proteobakterien gebildet werden. Eine stark eiweißreiche Kost wird von proteolytischen Bakterien, z.B. durch die im Darm reichlich vorkommenden Bacteroides, verstoffwechselt, fördert das Wachstum der Proteobakterien und trägt so zu einem basischen pH im Stuhl bei. Ebenso führt eine Verminderung der säurebildenden Bifidobakterien und Laktobazillen zu einer Verschiebung des pH-Wertes in Richtung basisches Milieu. Ein gestörtes bakterielles Gleichgewicht kann durch Darmreinigung und Ernährungsumstellung auf probiotische und ballaststoffreiche Kost wiederhergestellt werden. Der pH-Wert ist Bestandteil unserer Mikrobiota- und Check-up-Profile, kann aber auch einzeln angefordert werden. Unseren Anforderungsschein für die Stuhldiagnostik finden Sie hier.
Vorweg: Histamin aus der Nahrung hat nahezu keinen Einfluss auf den Histaminspiegel im Blut. Wenn wirklich die klassischen Ursachen vermehrter Histaminbildung und auch ein reduzierter Histaminabbau (DAO-Aktivität) ausgeschlossen sind, dann sollte danach geschaut werden, ob eine Dysbiose-bedingte vermehrte Histaminbildung im Darm dafür verantwortlich ist. Verschiedene Bakterien, insbesondere Klebsiella pneumoniae, Morganella morganii und Hafnia alvia wandeln sehr effektiv das Histidin aus der Nahrung in Histamin um. Patienten, die eine vermehrte Ansiedlung dieser Bakterien im Darm haben, tragen im Grunde ihre eigene Histaminquelle immer mit sich. Vor allem wenn zusätzlich eine gestörte Darmbarriere vorliegt, kann Histamin leicht in das Portalblut übertreten und in den peripheren Blutkreislauf gelangen und einschlägige Symptome verursachen. Zur Abklärung dieser versteckten Quelle empfiehlt sich die Untersuchung "Histaminbildner im Stuhl". Ergänzend bieten sich die Stuhlanalysen Histamin, a-1-Antitrypsin (leaky gut-Marker) sowie das Eosinophile Protein X (EPX) an. Mit letzterem schließt man eine Eosinophilenaktivierung in der Darmwand aus, die (in seltenen Fällen) neben den Bakterien auch für erhöhte Histaminbildung im Darm verantwortlich sein könnte. Bei auffälligem Befund der Histaminbildner sollte die Dysbiose durch Darmreinigung (z.B. Flohsamenschalen, Aktivkohle, Oreganoöl, Pektin, Zeolith, u.a.), Präbiotika (z.B. Akazienfasern, Inulin, FOS, u.a.) und Probiotika ausgeglichen werden. Cave: viele Probiotika enthalten histaminbildende Bakterien, hier finden Sie weitere Informationen dazu. Zudem sollten vorübergehend nicht nur Histamin- sondern auch Histidin-reiche Nahrungsmittel reduziert werden. Diese sind: Fleisch (Rind, Schwein, Lamm, Huhn), Thunfisch und Lachs, ebenso Milch sowie Hartkäse, Bohnen, Linsen, Erdnüsse und Weizenkeime.
Unseren Anforderungsschein für die Stuhldiagnostik finden Sie hier.
Ja, bei Überwachung des Vitamin D-Stoffwechsels in der Schwangerschaft sind mehrere Besonderheiten zu beachten:
- Die Konzentration von totalem 25OH-Vitamin D steigt im Verlauf der Schwangerschaft deutlich an, weil Östrogene die Synthese von „Vitamin D Bindendem Protein“ (VDBP) stimulieren. Dieser Anstieg von VDBP führt jedoch nicht zu einem Anstieg des biologisch aktiven, freien Vitamin D. Das herkömmliche 25OH-Vitamin D ist daher bei Schwangeren schwierig zu interpretieren und die direkte Messung des freien Vitamin D umso bedeutsamer.
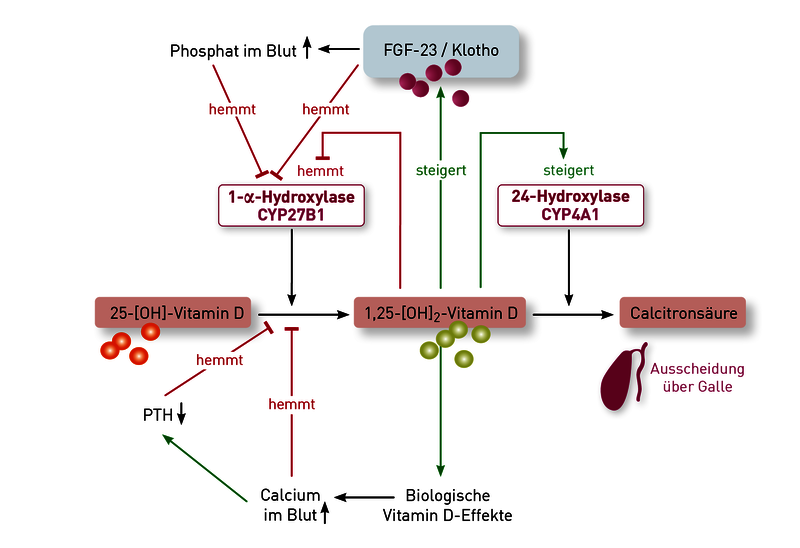
- Die Plazenta enthält hohe Konzentrationen des Enzyms 1-alpha-Hydroxylase und produziert daher große Mengen an 1,25 (OH)2-Vitamin D (siehe Abbildung). Eine gesunde Schwangere muss entsprechend etwa doppelt so hohe 1,25 (OH)2-Vitamin D-Konzentrationen aufweisen – scheinbar normale (d.h. für nicht-schwangere Frauen normwertige) 1,25 (OH)2-Vitamin D- Konzentrationen deuten bei Schwangeren auf erhebliche Probleme in der Plazenta hin.
- Sehr seltene, mütterliche und kindliche Gen-Defekte, z.B. im Gen der 24-Hydroxylase (siehe Abbildung), können zu bedrohlichen Hyperkalzämien des Neugeborenen führen, insbesondere wenn die Mutter während der Schwangerschaft mit hohen Dosen Vitamin D substituiert wurde. Freies 25(OH)-Vitamin D und 1,25 (OH)2-Vitamin D sollten daher im ersten und dritten Trimenon überprüft und als Richtwert für einen möglichen Substitutionsbedarf herangezogen werden. Bei Verdacht auf dieses Krankheitsbild ist auch eine Bestimmung von PTH und die entsprechende Gendiagnostik hilfreich (PTH ist bei diesem Gendefekt regelhaft supprimiert).
Dank großer epidemiologischer Studien ist mittlerweile klar: Mikrobiom und Umweltfaktoren spielen bei der Entstehung von Allergien eine zentrale Rolle. Ein harmonisches Zusammenspiel zwischen Darmmikrobiom und Immunsystem ist für die Immuntoleranz gegenüber Nahrungsmitteln und anderen harmlosen Umwelteinflüssen essentiell. Symbiose ist Voraussetzung für die Integrität der Darmbarriere, die regulierte Antigenpräsentation gegenüber dem adaptiven Immunsystem und letztlich die adäquate Bildung regulatorischer T-Zellen. Diese spielen eine zentrale Rolle für die Aufrechterhaltung der Immuntoleranz. Dysbiose und Leaky Gut führen zu einer unkontrollierten Exposition mit immunogenen Inhalten des Darmlumens und induzieren damit eine Immunaktivierung, die die Entstehung von Typ I- aber auch Typ IV-Allergien auf Nahrungsmittelbestandteile begünstigt. Wie erfolgt die Kommunikation zwischen Darmbakterien und Immunsystem? Hier spielen Stoffwechselprodukte des Mikrobioms eine wichtige Rolle: Beim Abbau von Ballaststoffen produzieren bestimmte Bakterienstämme kurzkettige Fettsäuren (Butyrat, Propionat, Acetat). Insbesondere Butyrat stärkt die Schleimhautbarriere und fördert die Induktion regulatorischer T-Zellen. Ein hoher Butyratgehalt im Stuhl im Säuglingsalter und eine ausreichende Anzahl an butyratbildenden Bakterien im Stuhl von Kindern sind mit einem signifikant geringeren Allergierisiko assoziiert.
Zur Allergieprävention im Säuglings- und Kindesalter ist aus diesen Gründen eine Untersuchung des Darmmilieus ratsam. In diesem Zusammenhang empfehlen sich folgende Analysen:
1. Kurzkettige Fettsäuren im Stuhl:
Auskunft über die aktuelle Acetat-, Propionat- und Butyratversorgung. Ein verminderter Wert deutet entweder auf eine unzureichende Zufuhr an präbiotischen Nahrungsmitteln oder auf eine reduzierte Funktion oder Anzahl an Butyratbildnern hin.
2. Molekulargenetisches Mikrobiota-Profil
Ermittelt u.a. die Stärke einer bakteriellen Dysbiose (Dysbioseindex) und das Vorkommen von Butyratbildnern im Stuhl des Patienten, sowie weitere für die Immuntoleranz wichtige Bakterien (z.B. Mukosaprotektive Bakterien). Bei sehr stark reduzierten Butyratbildnern empfiehlt sich neben prä- und probiotischer Behandlung ggf. zusätzlich eine temporäre Gabe von Butyrat.
3. pH-Wert (im molekulargenetischen Profil enthalten)
Ein alkalischer pH-Wert stört die Butyrat-bildenden Stoffwechselprozesse und kann auf einen Mangel an säurebildenden Bakterien hindeuten – es empfiehlt sich eine präbiotische Behandlung begleitet von einer Ernährungsumstellung.
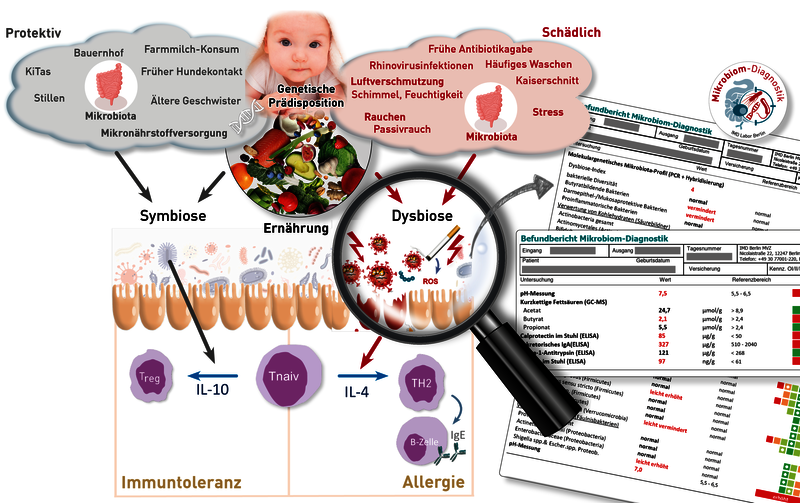
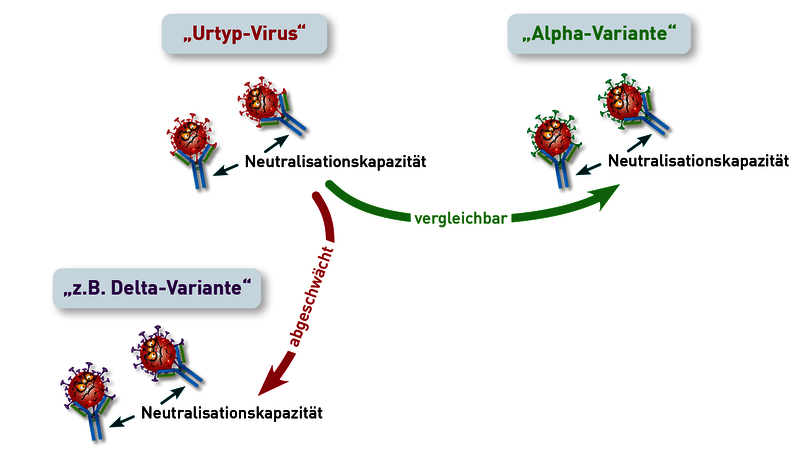
Nein, die Schutzwirkung SARS-CoV-2-spezifischer Antikörper gegenüber Omikron kann nicht durch den herkömmlichen Surrogat-SARS-Neutralisationstest ermittelt werden. Hier ist der neue Omikron-Neutralisationstest weit überlegen. Vor dem Auftreten von Omikron korrelierte die Höhe der IgG (S1)-Titer sehr gut mit der Neutralisationskapazität gegenüber den verschiedenen SARS-CoV2-Varianten. Mit der Ausbreitung von Omikron ergaben sich bald Hinweise, dass die Wirksamkeit der durch die Impfung oder Infektion (nicht Omikron-Variante) gebildeten Antikörper gegenüber der Omikron-Variante deutlich vermindert sei. Aufgrund vieler Mutationen im Omikron-Spikeprotein 1, passen die zuvor generierten IgG (S1)-Antikörper nicht mehr exakt und verlieren dadurch ihre Bindungs- und somit auch ihre Neutralisationsfähigkeit. Bisher verfügbare und zugelassene Tests zur Messung der Neutralisationskapazität bezogen sich ausschließlich auf die Bindungsfähigkeit der Antikörper an die Wildtypvariante (ursprüngliches Virus). Da auch alle bisherigen Impfungen auf dem Spikeprotein der Wildtyp-Viren beruhen, kann hiermit effizient getestet werden, ob sich eine humorale Immunität entwickelt hat. Unsere eigenen Austestungen zeigen allerdings, dass daraus auf die Schutzwirkung gegenüber der vorherrschenden Omikron-Variante kaum Rückschlüsse gezogen werden können (siehe Abbildung). Obwohl jeder Proband der Austestung, entweder geboostert oder genesen, einen IgG (S1)-Wert > 384 BAU/ml aufwies und eine vergleichbare Neutralisationskapazität von >90 % gegenüber der Wildtyp- und Delta-Variante zeigte, variierte die Neutralisationsfähigkeit gegenüber der Omikron-Variante von Proband zu Proband deutlich. Die Höhe des IgG (S1)-Titers korreliert in Bezug auf Omikron nun nicht mehr mit der Wirksamkeit der Antikörper. Seit März kann daher am IMD Berlin die Neutralisationsfähigkeit wahlweise gegenüber der Wildtyp und / oder der Omikron-Variante getestet werden.
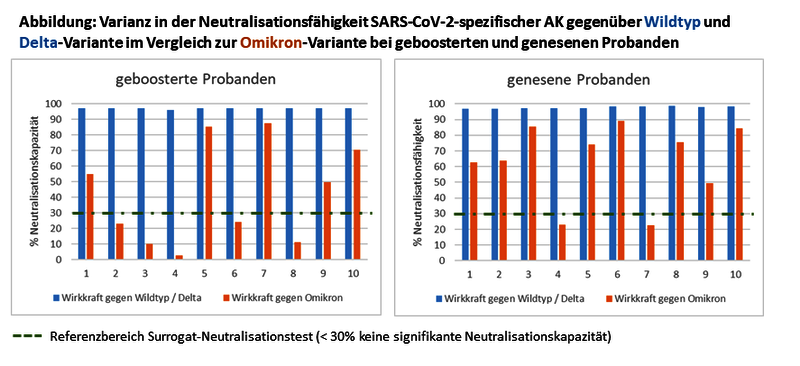
Der Begriff „Neurostress“ bezieht sich populärwissenschaftlich auf eine verminderte Produktion von Stresshormonen in den Nebennieren und damit auf Zustände einer leichten Nebenniereninsuffizienz, die von einem Morbus Addison abgegrenzt werden kann. Aussagekräftige Laborparameter stellen das „Cortisol-Tagesprofil im Speichel“ und der Sexualhormon-Vorläufer „DHEAS im Serum“ dar:
• Charakteristisch ist eine Abflachung des Cortisol-Tagesprofil auf niedrigem Niveau, entsprechend einer wenig ausgeprägten zirkadianen Rhythmik des Stresshormons Cortisol. Die abgeflachte Kurve geht häufig mit Müdigkeit und Antriebslosigkeit einher.
• DHEAS wird wie Cortisol in der Nebennierenrinde gebildet und ist Vorläufer für Steroidhormone. Auch eine reduzierte Synthese der Sexualhormone kann Erschöpfungssymptomen zugrunde liegen.
Wenig aussagekräftig ist hingegen die Messung von Katecholaminen (Adrenalin, Noradrenalin, Dopamin) im Urin oder Plasma – insbesondere deshalb, weil die Konzentrationen von Stresshormonen hohen interindividuellen Schwankungen unterliegen, die eine Insuffizienz vortäuschen bzw. kaschieren können. Entsprechung wird auch bei Cortisol nicht die einzelne Konzentration, sondern die Veränderung im Tagesverlauf beurteilt. Klar ist, dass die von der Nebenniere ausgeschütteten Katecholamine als Stresshormone fungieren und allenfalls mit der individuellen Sympathikus-Aktivierung korrelieren. Sie liefern hingegen keinerlei Aussagen über den Neurotransmitterhaushalt im peripheren oder gar zentralen Nervensystem. Die eng regulierte, präzische Ausschüttung winziger Mengen von Neurotransmittern an den Synapsen kann über Untersuchungen von Blut oder Urin nicht erfasst werden. Es ist lediglich möglich, im Blut den Versorgungsstatus mit Ausgangssubstanzen und Kofaktoren der Neurotransmittersynthesen zu analysieren (u.a. Tryptophan, Tyrosin, Phenylalanin, Vitamin B6, B12, Magnesium). Ein Rückschluss auf „Neurostress“ innerhalb des ZNS im Sinne einer Fehlregulation auf immunologische und endokrine systemische Reize ist über Labordiagnostik nicht möglich, weder aus Urin, Blut und Speichel.
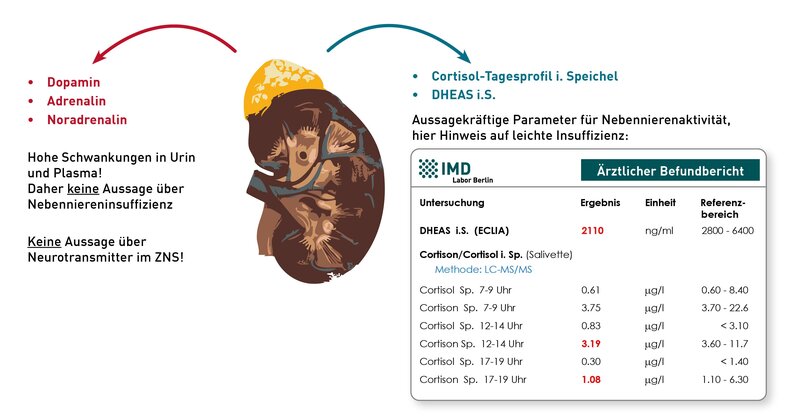
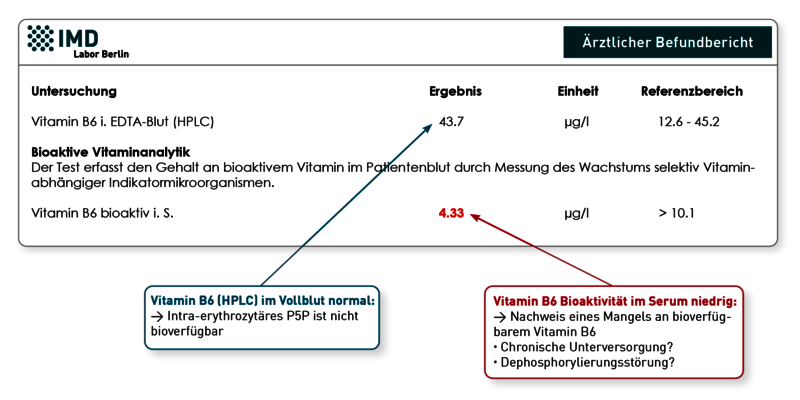
Das zur oralen Vitamin B6-Substitution häufig verwendete Pyridoxin wird in den roten Blutkörperchen rasch in Pyridoxalphosphat (P5P) umgewandelt. Am höchsten ist die intra-erythrozytäre P5P-Konzentration 1-2 Stunden nach der oralen Einnahme. Anschließend wird P5P zu Pyridoxal metabolisiert und in dieser Form wieder ans Plasma abgegeben und über das Blut verteilt. Pyridoxal kann direkt ins Gewebe aufgenommen werden. Aufgrund dieser Verstoffwechslung lassen sich zwei Erklärungen für die scheinbar diskrepanten Vitamin B6-Ergebnisse ableiten:
1) Der Patient hat kurz vor der Blutentnahme ein Substitutionspräparat eingenommen. Das aufgenommene Vitamin B6 liegt nun in hohen Konzentrationen in den Erythrozyten in Form des P5P vor, welches durch die Vollblut-Bestimmung in der HPLC erfasst wird. Liegt generell ein Mangelzustand vor, wird das ins Plasma abgegebene Pyridoxal relativ schnell ins Gewebe aufgenommen. Das folglich niedrige bioaktive Vitamin B6 spiegelt die chronische Mangelsituation wieder. Dies zeigt, dass anders als bei vielen anderen Mikronährstoffen bei Vitamin B6 gerade nicht die Vollblutanalyse, sondern die Serumanalyse den langfristigen Versorgungsstatus abbildet.
2) Kann Punkt 1 ausgeschlossen werden, könnte eine Dephosphorylierungsstörung vorliegen, wodurch die Umwandlung/Dephosphorylierung von P5P gehemmt ist. Da nur die dephosphorylierte Form aus den Erythrozyten ins Plasma abgegeben wird, akkumulieren hohe P5P-Spiegel in den roten Blutkörperchen, ohne dass das Gewebe mit Vitamin B6 versorgt wird. Hohes P5P im Vollblut wäre in diesem Fall Ausdruck eines funktionellen Mangels.
In der Praxis beobachten Therapeuten immer wieder, dass Patienten mit normalem/erhöhtem HPLC-Vitamin B6 im Vollblut und niedrigem bioaktiven Vitamin B6 im Serum von einer Vitamin B6-Gabe profitieren. Ein Monitoring ist hier nur über die Bioaktivität messbar.
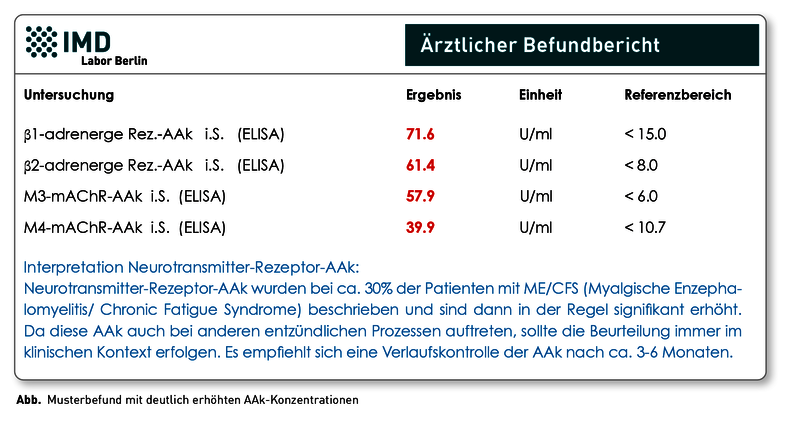
Das Chronische Fatigue Syndrom (CFS), auch Myalgische Enzephalitis (ME) genannt, ist eine sehr schwere Erkrankung, die in ca. 2/3 der Fälle durch eine Infektion ausgelöst wird, beispielsweise nach einer Grippe oder EBV-Infektion. Auch im Zusammenhang mit dem Coronavirus SARS-CoV-2 wurde beobachtet, dass ein Teil der Patienten Wochen bis Monate nach dem Infekt Beschwerden entwickeln, die als „Long-COVID“ oder „Post-COVID-19-Syndrom“ bezeichnet werden und an ME/CFS erinnern. In solchen infektbedingten Fällen ist das CFS/ME höchstwahrscheinlich eine Autoimmunerkrankung, die auch mit dem Auftreten von verschiedensten Autoantikörpern (AAk) assoziiert ist. Eine besondere Rolle spielen dabei u.a. Antikörper, die sich gegen Neurotransmitter-Rezeptoren richten. In einer Studie wurden bei einem Teil der CFS/ME-Patienten erhöhte AAk gegen adrenerge und muskarinerge Acetylcholin-Rezeptoren nachgewiesen. Diese AAk gehören zur Gruppe der sogenannten G-Protein-gekoppelten Rezeptoren (GPCR) und sind Teil eines regulatorischen Netzwerkes, das bei zahlreichen Erkrankungen dysreguliert ist. Sie sind an der Pathogenese verschiedener Autoimmun- und Nicht-Autoimmunerkrankungen beteiligt. Auch wenn die Neurotransmitter-Rezeptor-AAk keine spezifischen Biomarker für das CFS/ME sind, können sie unterstützend zur Diagnosestellung von ME/CFS herangezogen werden. Aktuell haben positive Neurotransmitter-Rezeptor-AAk-Befunde keine direkte therapeutische Relevanz. Detaillierte Hintergründe finden Sie in unserer aktualisierten Diagnostik-Information.
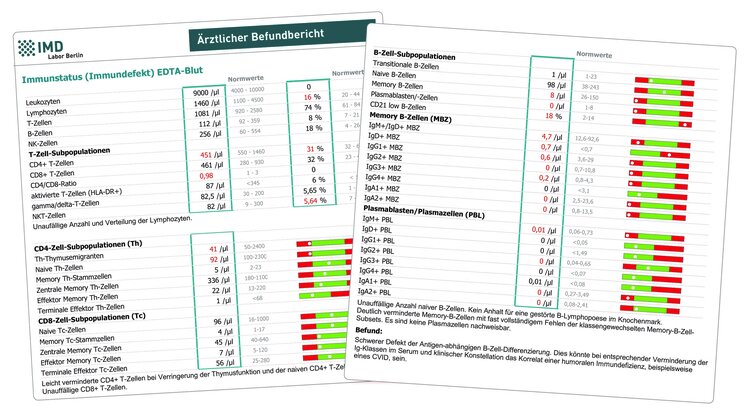
Diese Untersuchung wurde durch unser Labor für die Diagnostik von angeborenen Immundefekten entwickelt. Entgegen der weit verbreiteten Meinung, dass diese Erkrankungen nur im Kindesalter auftreten und mit einer schweren Infektanfälligkeit einhergehen, werden 50 % der Diagnosen erst bei Erwachsenen gestellt. Dies liegt unter anderem daran, dass unter Umständen klinisch die Infektanfälligkeit nicht im Vordergrund steht, sondern andere Symptome wie Autoimmunität, unklare Entzündungen oder Fatigue dominieren. Die häufigste Diagnose bei diesen Patienten sind Störungen des B-Zell-Systems, die mit einem Antikörpermangel einhergehen.
Im „zellulären Immunstatus Immundefekt“ wird dementsprechend eine umfassende Analyse derjenigen Immunzellen vorgenommen, die an Antikörperantworten beteiligt sind (T- und B-Lymphozyten). Hierbei werden Anzahl und Entwicklungsstufen dieser Zellen quantifiziert und damit Bildung und aktivierungsbedingte Differenzierung der Lymphozyten nach Kontakt mit Antigenen überprüft. Darüber hinaus erfolgt eine Analyse der IgG- und IgA-Subklassen-Produktion durch die B-Lymphozyten, so dass das zelluläre Korrelat eines IgG-Subklassen- oder IgA-Mangels nachgewiesen werden kann.
Eingesetzt werden sollte der zelluläre Immunstatus „Immundefekt“ daher zur weiteren Abklärung bei Patienten mit Infektanfälligkeit, insbesondere dann, wenn ein Immunglobulinmangel oder ein Subklassendefekt bereits nachgewiesen wurde. Eine Bestimmung der Immunglobuline (IgA, IgG und IgM) sollte spätestens zeitgleich zum Immunstatus erfolgen, da ansonsten nur eine eingeschränkte Beurteilung erfolgen kann.
Da überschüssiges Vitamin C effizient ausgeschieden wird, spielt die Labordiagnostik bei Verdacht auf Vitamin C-Mangel eine untergeordnete Rolle. Vitamin C kann im Gegensatz zu anderen Mikronährstoffen durchaus „blind“ supplementiert werden. Wichtig ist allerdings vor Hochdosistherapie der Ausschluss einer genetischen Glukose-6-Phosphat-Dehydrogenase (G6PD)-Defizienz. Diese kann im Labor über den einfachen G6PD-Aktivitätstest detektiert werden.
Soll Vitamin C im Einzelfall dennoch gemessen werden, ist die anfällige Präanalytik zu beachten. Vitamin C ist lichtempfindlich und wird noch nach der Blutentnahme von den Zellen in der Blutprobe verbraucht. Dies kann zu falsch niedrigen Konzentrationen führen. Aufgrund dieser präanalytischen Anfälligkeit empfehlen wir eine Blutentnahme im Labor vor Ort.
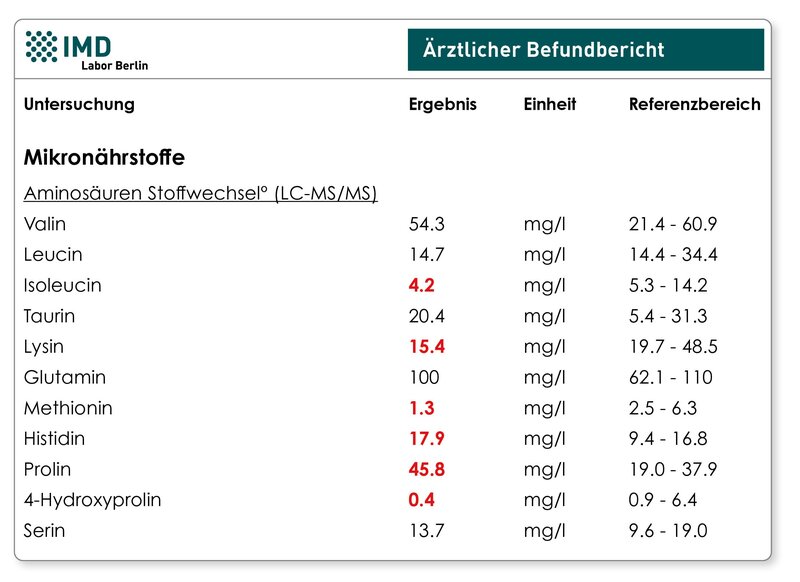
Alternativ zur direkten Bestimmung kann das „Aminosäureprofil Stoffwechsel“ einen Hinweis auf die Vitamin C-Versorgung geben. Ohne Vitamin C kann die Aminosäure Prolin nicht in Hydroxyprolin umgewandelt werden. Niedriges Hydroxyprolin bei normalem bis hohem Prolin weist auf eine unzureichende Vitamin C-Zufuhr hin. Das Verhältnis von Hydroxyprolin zu Prolin kann daher bei guter Verfügbarkeit von Prolin als Biomarker für die Vitamin C-Versorgung genutzt werden. Ein Mangel hingegen von Prolin, Vitamin C, Eisen und Vitamin B6 würde unter anderem den Aufbau von Bindegewebe beeinträchtigen.
Hyroxyprolin entsteht enzymatisch aus Prolin, Kofaktor: Vitamin C
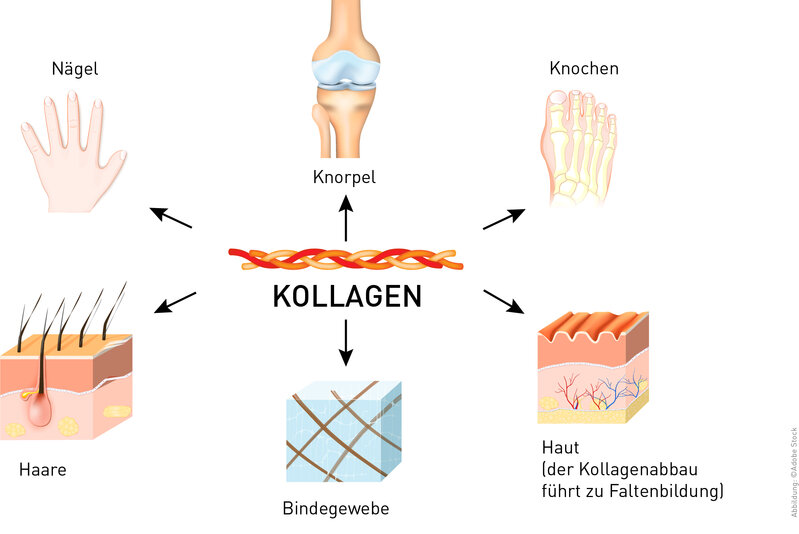
Vitamin C ist als Kofaktor essentiell für die Kollagensynthese. Daher stört ein Vitamin C-Mangel die Bildung von kollagenhaltigem Gewebe wie Haut, Knorpel, Knochen und Bindegewebe.
Die Bestimmung von spezifischem IgE gegen Allergenmischungen (z.B. der Baum-, Gräser-, oder Kräuterpollenmischung) ermöglicht v.a. unter Berücksichtigung der Kosteneffizienz eine breitgefächerte Abgrenzung der möglichen Allergieauslöser. Im nächsten Schritt werden häufig die einzelnen Mischungen ausdifferenziert. Dieses Vorgehen ist jedoch aufgrund der Kreuzreaktivitäten nicht immer zielführend. Nicht selten weisen wir in solchen Fällen IgE gegen alle Bestandteile der Mischung nach. So ist z. B. bei dem Nachweis von spezifischem IgE gegen Phl p1 und Phl p5 aus dem Lieschgras davon auszugehen, dass bei der Einzeltestung auch positive Ergebnisse auf alle Süßgräserpollen erzielt würden (siehe hierzu Rubrik „Wissenschaft am IMD“). Darüber hinaus wird bei der Ausdifferenzierung der Mischungen häufig der Höchstwert überschritten.
Für die SIT-Planung aussagekräftig und zudem kosteneffizient ist vielmehr die direkte Bestimmung der IgE-Antikörper gegen einzelne rekombinante Allergenkomponenten. Das Befundbeispiel illustriert dieses Vorgehen: Stellvertretend für die Ausdifferenzierung der Gräserpollenmischungen werden die Markerallergene Phl p1 und Phl p5 bestimmt, stellvertretend für Ausdifferenzierung der Baumpollenmischung das Markerallergen Bet v1 der Birke und Buchengewächse. Die Bestimmung von Ole e1 dient als Marker einer spezifischen Sensibilisierung auf Eschenpollen. Letztere blühen in Deutschland meist zur selben Zeit wie die Birke und können symptomatisch einer Birkenpollenallergie ähneln.
Mehr Informationen im Detail zur klinischen Aussagekraft der molekularen Allergiediagnostik finden sie auch hier.

Neutralisierende SARS-CoV-2-Antikörper haben die Fähigkeit, die Virusvermehrung zu hemmen, in dem sie die Bindung des Virus an die Wirtszelle und damit sein Eindringen ins Zellinnere stören. Im sogenannten Surrogat-SARS-Neutralisationstest kann diese Fähigkeit der im Serum befindlichen Antikörper geprüft werden. Surrogat-SARS-Neutralisationstests verwenden die Rezeptor-Bindungs-Domäne (RBD-Region), die im Spike-Protein liegt und in deren Bereich die Virusvarianten Mutationen aufweisen. Die aktuell auf dem Markt verfügbaren Tests – so auch der, den wir im IMD Berlin verwenden (cPass; GenScript-Medac) – basieren auf der Sequenz des „ursprünglichen“ SARS-CoV-2. Somit stellt sich die Frage, inwieweit sich die gemessene Neutralisationskapazität auf die Immunabwehr von Virusvarianten übertragen lässt. Laut Testungen und Aussage der Firma GenScript kann dieser die neutralisierenden Antikörper gegen die Alpha-Variante (B.1.1.7; vormals britische Variante) sehr gut erfassen. Das ist auch vom Konsiliarlabor in der Charité bestätigt worden und ebenfalls schriftlich auf der Website der Firma hinterlegt und einsehbar. Zu den weiteren Varianten gibt es zwar bisher keine offizielle Stellungnahme, man weiß jedoch durch Forschungsergebnisse, dass die Neutralisationskapazität, die durch Infektion mit dem ursprünglichen Virus oder durch Impfung erworben wurde, im Mittel etwas weniger wirksam gegenüber bestimmten Varianten, so auch der Delta-Variante, ist. Eine hohe Effizienz der Antikörper im cPass-Test von GenScript ist sicher eher vorteilhaft für die Immunabwehr anderer Virusvarianten, kann aber nicht eins zu eins übertragen werden, mit Ausnahme auf die Neutralisation der Alpha-Variante.
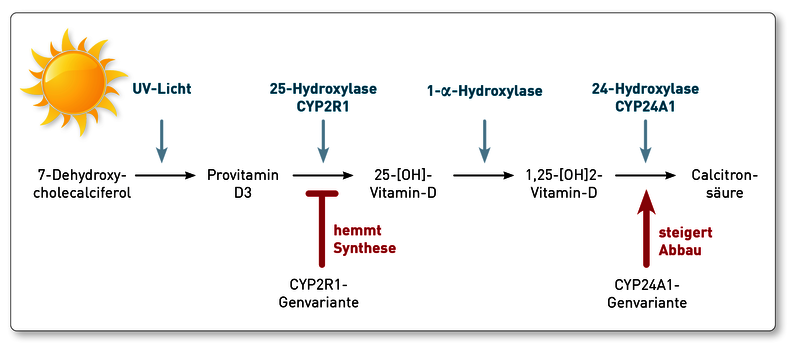
Die Pharmakokinetik von Vitamin D ist individuell sehr unterschiedlich. Dies beruht vor allem auf folgenden Einflussfaktoren:
Resorption: Vitamin D ist ein fettlösliches Vitamin und sollte daher zu den Mahlzeiten eingenommen werden. Es wird im Wesentlichen im Dünndarm resorbiert. Jegliche Erkrankung des Dünndarms kann daher – trotz adäquater oraler Zufuhr – einen Vitamin-D-Mangel begünstigen. Man sollte insbesondere Erkrankungen wie Zöliakie und chronisch entzündliche Darmerkrankungen ausschließen. Eine erhebliche (gewollte) Verringerung der resorptiven Oberfläche im Dünndarm haben aber auch Patienten mit Z n. bariatrischer Chirurgie. Diese Patienten sind aber insbesondere zur Verbesserung ihrer oft pathologischen Insulinresistenz auf eine adäquate Vitamin-D-Versorgung angewiesen.
Metabolismus: Die Enzyme, die Vitamin D metabolisieren ((25-Hydroxylase, 1-alpha-Hydroxylase und 24-Hydroxylase) kommen beim Menschen in unterschiedlichen Genvarianten vor. Der Summationseffekt dieser Varianten ist entweder eine Verlangsamung oder eine Beschleunigung des Metabolismus und damit eine Verlangsamung oder Beschleunigung des Anstiegs von Vitamin D im Blut nach Substitution. In den letzten Jahren gibt es darüber hinaus Hinweise, dass die Gene, die für den Metabolismus von Vitamin D verantwortlich sind, auch erheblichen epigenetischen Veränderungen unterliegen. Diese tragen ebenfalls zur Variabilität des Konzentrationsanstiegs im Blut nach oraler Vitamin-D-Gabe bei.
Empfehlung: Aufgrund dieser aus den oben genannten Gründen sehr hohen Variabilität der Vitamin-D-Blutkonzentrationen nach oraler Gabe und der Tatsache, dass sowohl Mangel als auch Überdosierung zu vermeiden sind, schlagen wir ein pragmatisches Vorgehen bei der Vitamin-D-Substitution vor. Beginnen sollte man die Substitution mit Dosen nach den Empfehlungen der jeweiligen Fachgesellschaften. Diese Therapie muss dann aber durch Bestimmung von Vitamin D (das freie 25(OH) Vitamin D ist hier vorzuziehen, da es besser die biologische Aktivität des Vitamin-D-Systems widerspiegelt) überwacht und entsprechend angepasst werden. Feste Schemata ohne Kontrollen sind aufgrund der oben beschriebenen Variabilität der individuellen Antworten zu vermeiden. Die genetische Untersuchung der metabolisierenden Enzyme 25-Hydroxylase (CYP2R1) und 24-Hydroxylase (CYP24A1) sowie des Vitamin-D-Bindeproteins (VDBP) liefern wichtige prognostische Anhaltspunkte.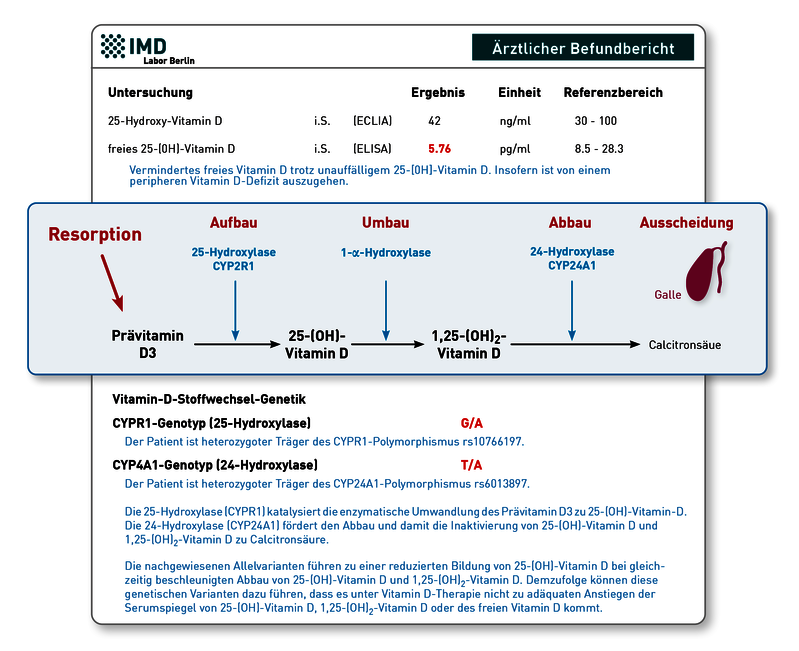
Der TAS-Test (Totaler Antioxidanzien Status) ist ein 1993 als sehr einfacher Screeningtest eingeführtes Laborverfahren, um die Kapazität aller im Patientenplasma vorhandenen Oxidations-hemmenden Moleküle zu erfassen. Auch wenn das auf den ersten Blick plausibel klingt, ist der Test ungeeignet, den Versorgungsstatus oder gar Substitutionsbedarf eines Patienten einzuschätzen, weil in diesen Test neben den klassischen Antioxidanzien wie Vitamin C oder E auch Plasmaproteine wie Albumin aber auch Harnsäure und Cholesterin eingehen und das wegen ihrer großen Menge sogar überproportional. Das erklärt sich in Kenntnis des Testprinzips. Es wird die hemmende Wirkung des Gesamtplasmas auf die Oxidation von ABTS (2,2′-Azino-di-3-ethylbenzthiazolinsulfat) durch zugegebenes Metmyoglobin erfasst wird. So wird z.B. ein Patient mit Gicht (hohe Harnsäure) oder Fettstoffwechselstörung (hohes Cholesterin) im TAS-Test oft eine gute antioxidative Kapazität zeigen, obwohl der Patient signifikante Defizite beim Coenzym Q10, Vitamin E oder Glutathion hat. Patienten mit niedrigem Gesamtprotein (Albumin) oder Patienten mit durch Fettsenker stark verminderten Cholesterinwerten haben dagegen immer schlechte Werte, selbst wenn die einzelnen echten Antioxidanzien in ausreichender Menge vorhanden sind. Die zellulären Anteile, so z.B. das intrazelluläre Glutathion, werden gar nicht erfasst, weil zellfreies Plasma eingesetzt wird. Es erfolgt keine Differenzierung zwischen wasser- und lipidlöslichen (zellgängigen) Antioxidanzien.
Die 2008 erschienene Empfehlung des Robert-Koch-Institut "Oxidativer Stress und Möglichkeiten seiner Messung aus umweltmedizinischer Sicht" rät von der Verwendung des TAS-Test ab mit der Begründung, dass es heute die Möglichkeit gibt, die entscheidenden Antioxidanzien direkt im Labor zu analysieren und sie entsprechend der gefundenen Spiegel gezielt zu substituieren.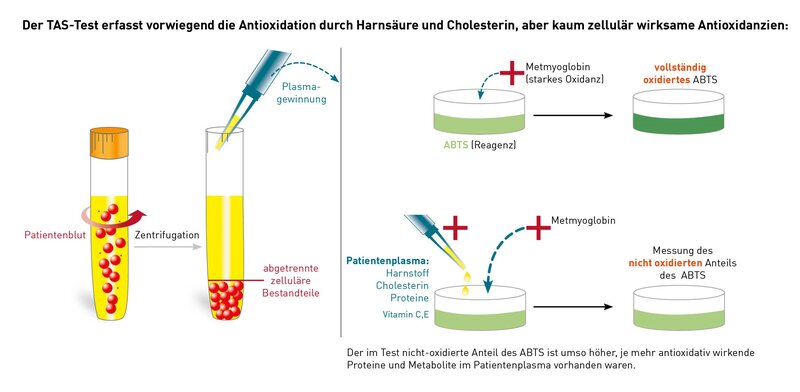
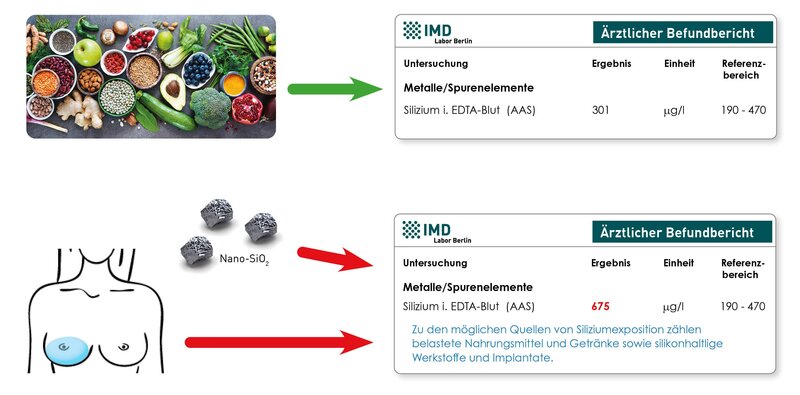
Die Untersuchung von „Silizium im EDTA-Blut“ kann bei dieser Fragestellung einen Hinweis liefern. Silizium ist ein Baustein von Silikon, einer Studie zufolge weisen daher Frauen mit Silikonimplantaten durchschnittlich höhere Silizium-Konzentrationen im Blut auf. Bei erhöhtem Silizium sind allerdings auch andere Expositionsquellen zu berücksichtigen, vor allem die Aufnahme von Siliziumoxid-Nanopartikeln aus Kosmetika und Nahrungsergänzungsmitteln. Eine niedrige oder unauffällige Siliziumkonzentration hingegen spricht gegen eine vermehrte Fremdstofffreisetzung aus einem Silikonimplantat.
Gleichzeitig wird Silizium als potentiell essentielles Spurenelement und Antagonist von Aluminiumbelastungen diskutiert. Aufgrund des natürlichen Siliziumgehalts vieler pflanzlicher Nahrungsmittel weisen alle Personen eine messbare Silizium-Konzentration im Blut auf. Ein erhöhter Spiegel kann daher auch Folge der Zufuhr siliziumreicher Nahrungsmittel oder Getränke sein.
Zu geringeren Teilen können in Brustimplantaten auch Metalle wie Nickel, Platin und Zinn enthalten sein. Bei Fremdstofffreisetzung aus schadhaften Implantaten ist daher eine Belastung des umliegenden Gewebes mit diesen Metallen möglich. Ein Anstieg der Konzentrationen im EDTA-Blut wurde jedoch bisher in der Literatur nicht beschrieben.
Die Impfung, wie auch die natürliche Infektion, induziert sowohl eine Antikörperantwort (humorale Immunität) als auch SARS-CoV-2-spezifische T-Gedächtniszellen (zelluläre Immunität). Zu deren Nachweis kommen für die humorale Immunität der SARS-CoV-2-IgG-Titer gegen das Spike-Protein (S1) und neuerdings auch der Surrogat-Virus-Neutralisationstest (sVNT), sowie für die zelluläre Immunität der LTT-SARS-CoV-2 in Frage.
Trotz guter Korrelation zwischen dem SARS-CoV-2-IgG(S1)-Titer und der Neutralisationskapazität im sVNT kann der letztgenannte Test aber dennoch, vor allem bei einem niedrigeren IgG-Titer unter 150 BAU/ml, sowie in Grenzbereichen mehr Klarheit schaffen über die tatsächlich schützenden funktionellen Eigenschaften der vorhandenen SARS-CoV-2-IgG (S1)-Antikörper. Andere Antikörper wie SARS-IgG(Nc), -IgA oder -IgM sowie Global- oder Antikörperschnelltests sind lediglich für die Infektionsdiagnostik von Bedeutung, sind aber kein Gradmesser eines immunologischen Schutzes.
Für den Nachweis SARS-CoV-2-spezifischer-T-Gedächtniszellen gibt es sowohl den LTT auf die SARS-CoV-2-Peptide des Spike-Proteins (gemessen wird die Proliferation der Zellen), als auch den Elispot, der die Botenstoffe der T-Zellen misst. Zumindest bei unseren vergleichenden Analysen zeigte der LTT im Vergleich zum Elispot die höhere Sensitivität und Spezifität.
Zu beachten ist, dass die STIKO derzeit eine Laborkontrolle des Impferfolges (noch) nicht empfiehlt. Zum einen hätte eine zu geringe Immunreaktion derzeit auf Grund mangelnder Impfstoffressourcen keine Konsequenz (keine unmittelbare Nachimpfung vorgesehen), zum anderen gibt es aktuell bei keinem der drei Tests definierte Entscheidungsgrenzen, ab wann ein Schutz besteht und wie lange dieser anhält. Das ist auch korrekt. Hier muss man Langzeitstudien abwarten, die heute noch gar nicht vorliegen können. Allerdings können die Resultate der drei genannten Testverfahren auf Grund sehr hoher Spezifität zumindest für jeden persönlich die Aussage treffen, ob das Immunsystem reagiert hat. Ob immunologische Befunde zukünftig eine rechtliche Konsequenz im Sinne eines Immunitätsnachweises haben werden, ist bisher nicht festgelegt. Aktuell trifft das nicht zu. 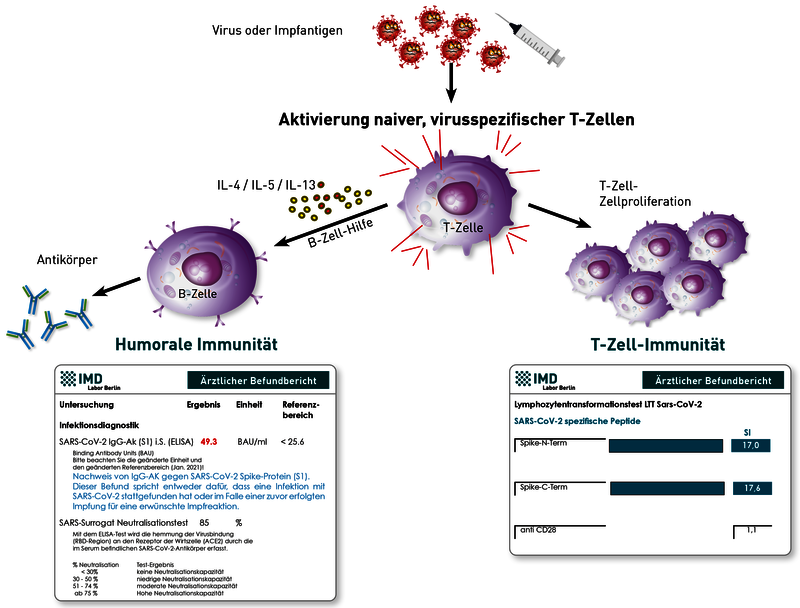
Grundsätzlich lässt die Entgiftungsgenetik Patienten erkennen, die exogene toxische Substanzen weniger effizient abbauen, schlechter ausscheiden und somit zur Anreicherung von Organbelastungen neigen. Gleichermaßen identifizieren die genetischen Untersuchungen aber Patienten, die endogene, durch Zellstress entstehende reaktive Sauerstoffverbindungen unzureichend eliminieren. Diese lebenslange Risikokonstellation zu erkennen, kann Arzt und Patient bei präventiven Ansätzen (Reduktion der Fremdstoffbelastung, Versorgung mit Antioxidantien u.a.) grundlegend unterstützen. Darüber hinaus ergeben sich jedoch auch spezifische praktische Konsequenzen aus den einzelnen Genveränderungen:
CYP-450-Enzyme: Sie sind für die Phase 1 der Metabolisierung von Fremdstoffen verantwortlich. Genetische Polymorphismen können sich daher nicht nur deutlich auf die Wirksamkeit von Medikamenten auswirken (z.B. CYP2D6 und Antidepressiva), sondern z.B. auch auf die Verfügbarkeit von Vitamin D (bei Veränderung von CYP2R1 und CYP24A1). Die Kenntnis der Genetik kann hier helfen, die Dosierung von Medikamenten und Vitamin D zu verbessern.
GST-Enzyme und NAT2: Durch die Phase-2-Enzyme werden die in Phase 1 entstandenen Metabolite wasserlöslich / ausscheidbar gemacht. Eine genetische Einschränkung der Aktivität der Phase-2-Enzyme führt dazu, dass in der Phase 1 entstehende (z.T. sogar toxischere) Metabolite weniger effizient eliminiert werden. Für betroffene Patienten kann daher die Intensivierung der Phase 1 durch die Gabe hochdosierter Mikronährstoffe (besonders B-Vitamine) problematisch werden. Das wird dann oft als die Unverträglichkeit von B-Vitaminen erlebt. Wichtige Kofaktoren der Phase 2 sind u.a. Glutathion und weitere Aminosäuren und Selen. Labordiagnostisch werden die Kontrolle von Glutathion intrazellulär, Aminosäuren Stoffwechsel und eine Vollblutmineralanalyse empfohlen.
SOD2: Die mitochondriale Superoxiddismutase neutralisiert reaktive Sauerstoffspezies ("Radikale") in Mitochondrien. Patienten mit genetisch bedingt verminderter Enzymfunktion neigen dazu, oxidativen Stress gerade dann insuffizient abzufangen, wenn der mitochondriale Stoffwechsel gesteigert ist und dienen hier auch der Stoffwechselregulation. Dies tritt bei vermehrtem Energiebedarf der Zelle ein, wie z.B. in Immunzellen bei Entzündung oder in Muskelzellen bei körperlicher Aktivität. Radikale werden für Regulationsprozesse benötigt, aber ein Zuviel bedeutet Oxidativen Stress. Dieser schädigt körpereigene Strukturen, daher ist die Balance wichtig. Eine gute Versorgung mit Antioxidantien (Vitamin C, A, E, Coenzym Q10, Taurin aber auch die alpha-Liponsäure) sollte bei Patienten mit SOD-2-Mangel stets gewährleistet sein.
Die u.g. 5 Enzyme sollten hinsichtlich ihrer Genetik gemeinsam betrachtet werden. Eine Kombination genetisch reduzierter Enzymaktivitäten, z.B. der N-Acetyltransferase 2 (NAT2) und der GST´s hat eine größere Bedeutung.
Bei Patienten mit mehrfach auffälligen Polymorphismen, kann mithilfe folgender Mikronährstoffe eine teilweise Kompensation erreicht werden: Glutathion und Selen, Antioxidantien (Vitamin C, A, E, Coenzym Q10, Taurin, alpha-Liponsäure), über eine Verbesserung der Methylierung (Vitamin B12, Folsäure, SAM) kann die „Ablesbarkeit der Gene“ verbessert werden.

Abb.: Eingeschränkte Funktion der Enzyme GST-M1, GST-T1, NAT2 und SOD-2. Dies spricht für einen grundsätzlich erhöhten Bedarf an Antioxidanzien, eine verzögerte Ausscheidung von Metaboliten der Phase 1 (sowie auch Metallen!).
Immunglobulin E (IgE) ist im menschlichen Organismus hauptsächlich an Rezeptoren auf den Oberflächen von Mastzellen sowie von eosinophilen und basophilen Granulozyten gebunden. Seine Hauptfunktion ist die Abwehr von parasitären Infektionen (z.B. Helminthen und Protozoen). Die Bindung passender Antigene an zellgebundene IgE-Antikörper führt zur Ausschüttung von Histamin, Leukotrienen, Prostaglandinen und diversen weiteren proentzündlichen Mediatoren, welche essentiell für die Bekämpfung einer Parasitose sind. Richten sich die IgE-Antikörper fälschlicherweise gegen eigentlich harmlose Substanzen aus unserer Umwelt (z.B. Pollen, Nahrungsmittel), kann das zu Allergien führen. Richten sie sich gegen körpereigene Proteine, können sie Auslöser von Autoimmunerkrankungen (z.B. Urtikaria) sein.
Ist das Gesamt-IgE erhöht, kann das zwar auf eine floride Allergie hindeuten (allergische Rhinitis, Neurodermitis, Asthma oder Nahrungsmittelallergie), dennoch eignet sich das Gesamt-IgE nicht als Screening-Parameter bei Allergie-Verdacht, da es auch bei parasitären Infektionen, Autoimmunerkrankungen sowie diversen Immundefekten und Krebserkrankungen erhöht sein kann.
Liste möglicher assoziierter Erkrankungen
Bei allergologischer Fragestellung sollte daher neben dem Gesamt-IgE immer das spezifische IgE gegen den verdächtigten Auslöser bestimmt werden. Die parallele Untersuchung des Gesamt-IgE ermöglicht in diesem Fall eine optimierte Beurteilung der Ergebnisse. Ein spezifisches IgE ist wahrscheinlich dann von klinischer Relevanz, wenn es über 1% des Gesamt-IgE ausmacht. Auch bei einem erniedrigten Gesamt-IgE sollte eine weitere Abklärung erfolgen, denn dies könnte auf einen variablen Immundefekt hindeuten. Weitere Details über die Relevanz des Gesamt-IgE in der Labordiagnostik bietet Ihnen die neue Diagnostikinformation 341.
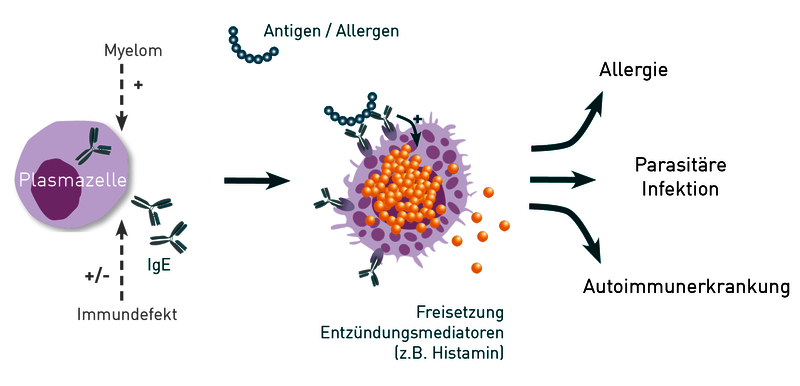
Abb.: Zellgebundene IgE-Antikörper erkennen spezifische Antigene und spielen so eine Rolle in der Bekämpfung parasitärer Infektionen aber auch bei Allergien und Autoimmunerkrankungen. Immundefekte und Krebserkrankungen können die Produktion von IgE-Antikörpern durch Plasmazellen beeinflussen.
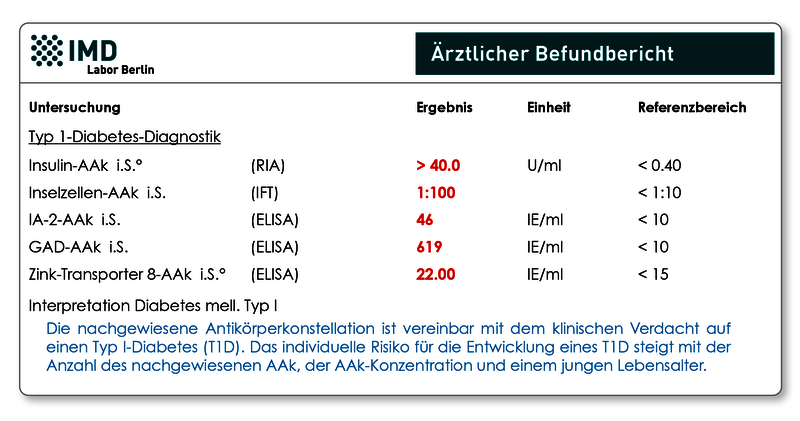
Obwohl wesentlich seltener als der Typ-2-Diabetes, kann der so genannte juvenile Diabetes auch erst im Erwachsenenalter auftreten. Er wird dann als LADA bezeichnet (Latent Autoimmune Diabetes of Adults) und ist für ca. 5-10% aller Diabetesfälle bei Erwachsenen ursächlich. Der LADA beginnt in der Regel abrupt (Tage bis Wochen) mit plötzlich einsetzenden Beschwerden und führt meist nicht sofort zur Insulinpflichtigkeit, weil die Bauchspeicheldrüse noch eingeschränkt Insulin herstellt. Dies erschwert die Abgrenzung zu dem im Erwachsenenalter typischen Typ-2-Diabetes, da die Betroffenen zunächst noch kein Insulin benötigen und auch primär adipös sein können. Die betroffenen Patienten sprechen häufig bereits nach wenigen Monaten nicht mehr auf eine Therapie mit Diät und Antidiabetika an, und eine Insulinbehandlung wird erforderlich. Allein die Bestimmung von Autoantikörpern (AAk) erlaubt sowohl die Differentialdiagnose zwischen Typ 1- und nicht-autoimmunen Diabetesformen, als auch das frühzeitige Erkennen einer Erstmanifestation, die häufig mit einer schweren Stoffwechselentgleisung einhergeht. Die aktuelle Leitlinie (S3-Leitlinie der DDG und AGPD; 2015) empfiehlt die Bestimmung der AAk gegen Insulin, Inselzellen, Glutamat-Decarboxylase (GAD), Tyrosinphosphatase (IA-2) und Zinktransporter 8 (ZnT8).
Wichtige Anhaltspunkte liefern das freie 25-OH-Vitamin-D sowie Genvarianten des Vitamin-D-Metabolismus. Ist das freie Vitamin D unter der Substitution in den Normbereich angestiegen und nur das Gesamt-25OH-Vitamin-D niedrig geblieben, spricht diese Konstellation für eine aktuell ausreichende Versorgung. Eine mögliche Erklärung für das trotzdem niedrige Gesamt 25OH-Vitamin-D wäre ein Polymorphismus im Vitamin-D-bindenden Protein (VDBP-Gen), wodurch sowohl die Konzentration als auch die Affinität des VDBP vermindert sein kann. Das würde bedeuten, dass der Patient weniger „Speicher“ anlegen kann. Sowohl die VDBP-Konzentration im Serum als auch die VDBP-Genetik kann im Labor untersucht werden. Falls jedoch auch das freie Vitamin D unter der Substitution erniedrigt bleibt – und Probleme der enteralen Resorption ausgeschlossen sind – kann die Ursache in genetischen Varianten liegen, die den Vitamin-D-Metabolismus stören. So verlangsamt eine Variante des Enzyms CYP2R1 (25-Hydroxylase) die Synthese von 25OH-Vitamin-D aus dem therapeutisch verabreichten Provitamin D. Ein Polymorphismus im CYP24A1-Gen (24-Hydroxylase) wiederum steigert den Abbau von 25OH-Vitamin-D und 1,25-(OH)2-Vitamin-D zur wirkungslosen Calcitronsäure. Daher führen diese Varianten unabhängig voneinander dazu, dass 25OH-Vitamin-D (sowohl Gesamt- als auch freies) trotz Substitution unzureichend ansteigt. Bei Vorliegen beider Genveränderungen wird der Effekt verstärkt. Während die Analytik des freien Vitamin D, der VDBP-Serumspiegel sowie die VDBP-Genetik bereits am IMD verfügbar war, haben wir nun auch die Genetik des Vitamin-D-Metabolismus (CP2R1- und CYP24A1-Gen) validiert. Weitere Hintergründe und Details finden Sie in unserer Diagnostikinformation „Vitamin D-Stoffwechselgenetik“.
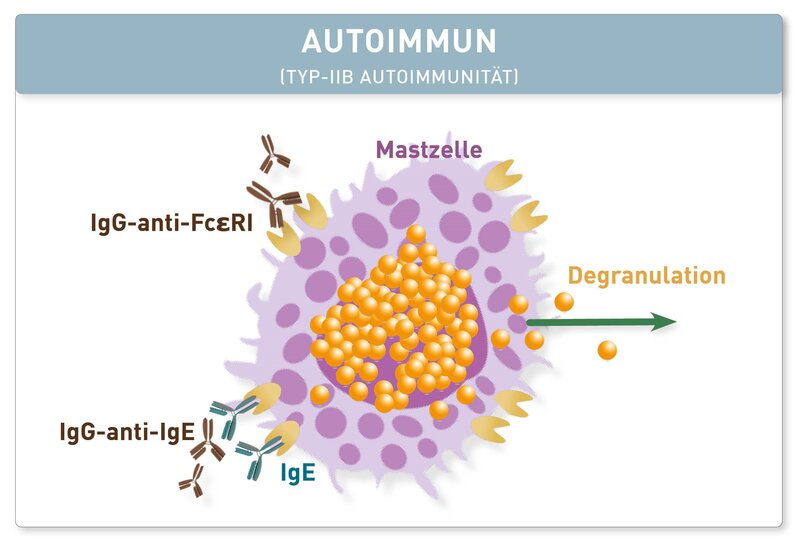
Die Urtikaria ist ein häufiges Krankheitsbild der Haut, bei dem es durch verschiedenartige Auslöser zur vermehrten Freisetzung von vasoaktiven Mediatoren (z.B. Histamin) aus den Haut-Mastzellen kommt. Als Folge entstehen juckende Rötungen, Quaddeln und/oder Angioödeme. Bleiben die Symptome länger als 6 Wochen bestehen, spricht man von einer chronischen Urtikaria. Häufigster Typ ist die Chronisch Spontane Urtikaria (CSU), bei der die Degranulation der Mastzellen oft über autoimmune Mechanismen ausgelöst wird, wie z.B. bei der CSU vom Typ IIb durch IgG-Antikörper, die gegen das körpereigene IgE oder den IgE-Rezeptor gerichtet sind (siehe Abbildung). Das Diagnosekriterium einer Typ-IIb-CSU ist bisher der sogenannte autologe Serumtest, bei dem das patienteneigene Serum in die Haut injiziert und die mögliche Quaddelbildung beobachtet wird. Solche Tests können für den Patienten sehr unangenehm sein und sind z.B. unter Anti-Histaminika-Einnahme beeinträchtigt. Der Basophilen Degranulationstest (BDT) bietet als „in vitro Provokationstest“ entscheidende Vorteile. Sind im Patientenserum die Autoantikörper gegen das auch auf den Basophilen Granulozyten gebundene IgE oder den IgE-Rezeptor vorhanden, so führt dessen Bindung daran unmittelbar zur Freisetzung der klassischen Mediatoren, zu denen auch die Leukotriene gehören. Diese werden im BDT gemessen. Somit kann der risikobehaftete in-vivo-Test vermieden werden. Ist die Typ IIb-CSU nachgewiesen, kann der Behandler seine Therapie dem Schweregrad entsprechend anpassen und z.B. die kontinuierliche Dosis an Antihistaminika erhöhen, da häufiger mit Angioödemen zu rechnen ist. Des Weiteren können Therapien mit anti-IgE-Ak (z.B. Omalizumab, Ligelizumab) zum Einsatz kommen, die direkt die Bindung von IgE an den IgE-Rezeptor erschweren und indirekt zur Verringerung der IgE-Rezeptoren an der Zelloberfläche führen. Aufgrund des hohen Leidensdrucks von CSU- Patienten ist in jedem Fall eine Diagnostik zur Ursachenfindung angeraten. Weitere Details über die CSU und die Durchführung der Laboruntersuchung bietet Ihnen die neue Diagnostikinformation 338.
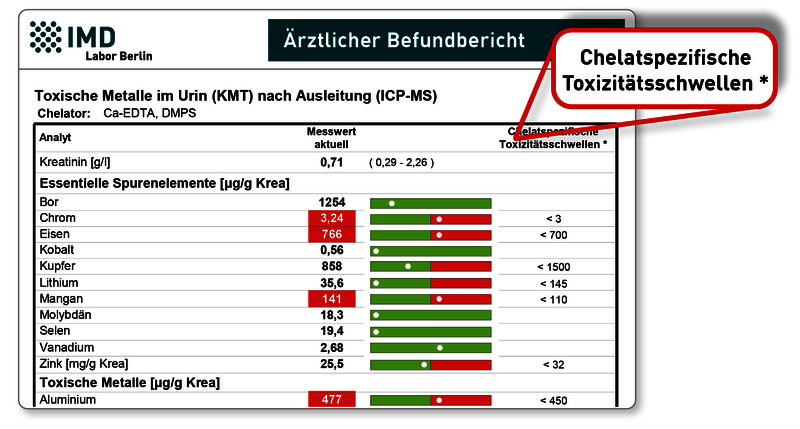
Der wesentliche Unterschied ist der Bezug der Metallwerte auf die „chelatspezifischen Toxizitätsschwellen“, die von der Ärztegesellschaft für Klinische Metalltoxikologie (KMT) für die Chelatierung mit Ca-EDTA+DMPS herausgegeben wurden. Das Chelatierungsprotokoll wird in den Weiterbildungen der KMT gelehrt. Alle Werte werden ausschließlich kreatininbezogen aufgeführt. Dadurch entsteht auf dem Befund Platz für eine grafische Darstellung (Befundbeispiel).
Das herkömmliche IMD-Profil stellt hingegen die im Urin in µg/l gemessenen Metallkonzentrationen ins Zentrum. Diese werden mit den Normbereichen des Basalurins verglichen – farblich hervorgehoben werden alle Konzentrationen, die über einen üblichen Basalurin ansteigen und damit (vermutlich) von einer Belastung des Gewebes herrühren. Die kreatininbezogenen Werte dienen hier der Verlaufskontrolle sowie ggf. einem Abgleich mit „Richtwerten“. Quelle der Richtwerte können die Auswertungen des Toxikologen Max Daunderer sein. Möglich ist es aber ebenso, aus den Messwerten der eigenen Praxis Richtwerte statistisch zu ermitteln, die zum eigenen Ausleitungsprotokoll passen. Falls dies für Sie von Interesse ist, sprechen Sie uns bitte an.
Grundsätzlich kann das „KMT-Profil“ nicht nur für die Ausleitung mit Ca-EDTA+DMPS, sondern auch nach Ausleitung mit anderen Chelatoren dargestellt werden. Es gilt jedoch die Einschränkung, dass bisher Toxizitätsschwellen für andere Chelatoren nicht verfügbar sind und daher nur die von Ca-EDTA+DMPS angezeigt werden können.
Da beide Befunddarstellungen – bei identischer Analytik – unterschiedliche Schwerpunkte haben, bieten wir sie gleichberechtigt an. Zur Anforderung des „KMT-Profils“ bitten wir um Verwendung des neuen Scheins „Metalltoxikologie“, oder alternativ um den handschriftlichen Hinweis „KMT“ neben Analyse 271 auf dem Schein „Spezielle Immundiagnostik“. Das herkömmliche Profil kann wie bisher auf den „Immundiagnostik“-Scheinen angekreuzt werden.
Ja, solche Fälle haben wir und andere beobachtet. Aus unserer Sicht bleibt das aber die Ausnahme, und es ist trotzdem sinnvoll und erfolgversprechend, auch nach Monaten die zurückliegende Infektion über die SARS-CoV2-IgG-Bestimmungen nachzuweisen. IgGs gegen das Spike-Protein (S1) zeigen die höhere Wertigkeit für diese Aussage. Die Angaben über die Häufigkeit dieser „Antikörperverluste“ sind diskrepant und abhängig vom Patientenkollektiv, v.a. von der Symptomstärke, aber auch vom verwendeten Antikörpertest. In der diesbezüglich viel zitierten Wuhan-Studie zeigen 40% der Patienten ohne Symptome, aber nur 12% der Patienten mit Symptomen nach mehr als 3 Monaten einen Verlust des IgGs (Long QX et al., Nature Medicine 2020). In einigen anderen Publikationen werden abfallende Titer gezeigt - in wie vielen Fällen die IgG-Titer aber tatsächlich unter die Nachweisgrenze gefallen sind, d.h. wirklich negativ geworden sind, geht aus den Daten meist nicht hervor. Das ist aber wichtig, weil zum Nachweis der früher stattgefundenen Infektion, die Höhe des Titers weniger wichtig ist als dessen Spezifität. Ebenso wenig zeigen die bisher veröffentlichten Daten, wie hoch die Zahl der lediglich grenzwertig positiven Ergebnisse war, die sich naturgemäß nicht immer bestätigen müssen (siehe Tabelle, hohe Zahl nicht bestätigter grenzwertiger IgG (Nc)-Ergebnisse in unserem Patientenkollektiv).
In unsere Auswertung gingen die am IMD-Berlin untersuchten Patienten ein, bei denen an mindestens 2 Zeitpunkten eine Untersuchung von SARS-CoV2-IgG gemacht wurde und die im Ausgangsbefund ein positives oder grenzwertiges IgG-Ergebnis zeigten. Diese Verläufe zeigen einen deutlichen Unterschied zwischen IgG gegen Nucleocapsid (Nc) und Spike-Protein (S1):
• Grenzwertige oder positive IgG (S1)-Titer bestätigten sich bei 83% der Patienten. Bei 17% zeigte sich ein Rückgang des Titers, jedoch wurden positive Titer in der Kontrolluntersuchung nie negativ.
• Grenzwertige oder positive IgG (Nc)-Titer bestätigten sich hingegen bei nur 40,5% der Patienten. 59,5% zeigten einen Rückgang, darunter auch 3 Patienten, die nach positivem Erstbefund in der Kontrolluntersuchung negativ wurden.
Lesen Sie hier eine ausführliche Diskussion dieser Auswertung.

Bei Anforderung von antinukleären Antikörpern (ANA) wird als Goldstandard immer die indirekte Immun-fluoreszenz (IFT) empfohlen. Der Vorteil besteht darin, dass in einem einzigen Analyseansatz das gesamte Antigenspektrum der ANA erfasst wird. Je nach Antigenlokalisation ergibt sich für jeden ANA ein charakteristisches Fluoreszenzmuster, das zusätzlich zum ANA-Titer im Befund angegeben wird. Positive ANA sollten immer, je nach diagnostischer Fragestellung und Fluoreszenzmuster, durch eine gezielte Differenzierung spezifiziert werden (z.B. dsDNA-AAk-ELISA, ENA-AAk-Blot.
Allerdings ist es bekannt, dass ANA, die sich gegen das Antigen SS-A(Ro) richten, im Immunfluoreszenztest nicht immer erfasst werden, d.h. negative ANA schließen das Vorhandensein von SS-A(Ro)-Antikörpern nicht sicher aus! In der Literatur wird die Häufigkeit mit 2 % angegeben. Bei dem in unserem spezialisierten Labor untersuchten Patientenkollektiv nehmen wir sogar einen höheren prozentualen Anteil an.
SS-A(Ro)-Antikörper werden vorwiegend bei Kollagenosen, vor allem beim Sjögren-Syndrom und verschiedenen Lupus erythematodes-Formen gefunden. Sie können auch schon Jahre vor der klinischen Manifestation nachweisbar sein und sichern eine rechtzeitige Diagnose.
Als Konsequenz dieser diagnostischen Lücke wird bei einem negativen ANA in der Immunfluoreszenz (IFT) die Bestimmung der SS-A(Ro)-AAk angeschlossen, um mit hundertprozentiger Sicherheit einen negativen ANA bewerten zu können.

Die wahrscheinlichste Ursache ist, dass in diesem Fall die IgG-Antikörpertestung 4 Wochen nach dem PCR-Nachweis noch zu früh stattgefunden hat. Zwar zeigen Studien, dass ca. 95% der Patienten drei Wochen nach Auftreten der ersten Symptome IgG-Antikörper haben, aber in diese Studien gingen immer Patienten mit schweren Krankheitsverläufen ein. Patienten mit leichteren oder gar fehlenden Symptomen (positiv abgestrichene Kontaktpersonen) zeigen bekanntermaßen eine verzögerte Antikörperbildung, häufig längere Zeit auch nur IgA-Antikörper und erst nach 5-6 Wochen den Wechsel zu IgG. Deshalb empfehlen wir immer die Kombination IgG und IgA.
Andererseits ist es in seltenen Fällen möglich, dass eine verzögerte oder gar fehlende Antikörperbildung durch einen Immundefekt bedingt ist. Das betrifft alle Viren, nicht nur SARS-CoV-2. Während primäre Immundefekte im Erwachsenenalter als Ursache nahezu auszuschließen sind, kommen sekundäre Antikörpermangelsyndrome häufiger vor und werden oft erst bei anlassbezogener spezifischer Diagnostik erkannt. Zu denken ist an hämatologische Grunderkrankungen (Verdrängung im Knochenmark durch pathologische Klone oder Störung der Hämatopoese), Morbus Cushing, Diabetes mellitus, Hypothyreose, bakterielle Infektionen, Z.n. Strahlen- oder Zytostatikatherapie, immunsuppressive Therapien).
Aber auch ein fehlender Antikörpertiter bedeutet nicht, dass keine Immunität (Infektionsschutz) bestehen kann. Die Immunität gegen Viren, und hier macht das Corona-Virus keine Ausnahme, wird zum großen Teil durch die T-Lymphozyten vermittelt, v.a. durch zytotoxische T-Zellen. Die Antikörper tragen zwar zur Virusabwehr bei, z. B. hemmen neutralisierende Antikörper den Eintritt des Virus in menschliche Epithelzellen, sie sind aber v. a. auch Epiphänomen, dass sich die T-zelluläre Immunabwehr ausgebildet haben muss (denn ohne T-Helferzellen keine Antikörperbildung).
Immunaktivierung steigert den Bedarf an Vitaminen und Spurenelementen. Gleichzeitig kann ein guter Versorgungsstatus nachweislich Infektionsrisiken senken. Studien dieser Art fehlen zwar weitgehend für das Coronavirus SARS-CoV2, einige Mikronährstoffe werden jedoch in der wissenschaftlichen Literatur diskutiert (Zhang et al., Journal of Medical Virology 2020):
- B-Vitamine
Insbesondere B6, aber auch andere B-Vitamine sind wichtige Kofaktoren der mitochondrialen Energiegewinnung und daher essentiell für eine optimale Funktion von Immunzellen. Eine gute Versorgung ist daher essentiell für eine Stärkung der Immunfunktionen. B2 zeigte in vitro eine spezifische Aktivität gegen das Coronavirus MERS-CoV. - Vitamin C
Studien zeigen, dass Vitamin C vor Infektionen der unteren Atemwege schützen kann. In Hühnern wurde zudem eine protektive Rolle gegenüber einem anderen Corona-Virus gezeigt. - Vitamin D
Aufgrund seiner weit reichenden Bedeutung für das Immunsystem vermutet man, dass eine gute Vitamin D-Versorgung auch für die Abwehr von SARS-CoV2 förderlich ist. In Kälbern wurde gezeigt, dass Infektionen mit einem bovinen Coronavirus durch Defizienzen an Vitamin D und E begünstigt werden. - Selen
Eine ausreichende Selenversorgung ist von zentraler Bedeutung für die Immunfunktion. Tiermodelle zeigen darüber hinaus spezifische schädigende Effekte eines Selenmangels, wie eine Verstärkung des Krankheitsverlaufes bei Influenza, sowie eine Steigerung der Virulenz verschiedener Erreger durch erhöhte Mutationsrate im Virusgenom. Von einer exzessiven, unkontrollierten Zufuhr ist angesichts der Corona-Epidemie dennoch abzuraten, da Selenverbindungen einem Bericht zufolge den ACE2-Rezeptor, das Eintrittstor von SARS-CoV2 in die Zelle, hochregulieren könnten. - Zink
Zink wird für die Differenzierung von T-Zellen benötigt, ein Vorgang, der essentiell ist für die Abwehr von akuten Infekten. Darüber hinaus wurden spezifische Interaktionen mit verschiedenen viralen Erregern belegt. So hemmt intrazelluläres Zink die Replikation verschiedener RNA-Viren, u.a. auch die des „ersten“ SARS-Virus (SARS-CoV). - Omega-3-Fettsäuren
In Tiermodellen wurden protektive Effekte von Omega-3-Fettsäuren gegenüber Influenza und Hepatitis C-Viren beobachtet. Der Versorgungsstatus der aufgeführten Mikronährstoffe kann sowohl über gezielte Einzelanalysen als auch im Rahmen von Diagnostikprofilen als bioaktive B-Vitamine, Vollblutmineralanalysen, Fettsäuren der Erythrozytenmembran untersucht werden. Bitte beachten Sie auch unser neues Profil „Vitalstoffe Infektneigung“ (Selen, Zink, Glutathion, Vitamin D, siehe 6-seitiger Schein).
Nach aktuellen Erkenntnissen kann eine gute Mikronährstoffversorgung der Krankheitsprogression und der Entstehung typischer Komorbiditäten wie Arteriosklerose, Hypertonus, Retinopathie und Neuropathie entgegenwirken. Folgende Zusammenhänge sind von besonderer therapeutischer Relevanz:
- Vitamin D fördert die Insulinsekretion der Beta-Zellen und wirkt damit der Insulinresistenz entgegen.
- Eine ausreichende Mineralstoffversorgung ist für die Funktion des Insulinsignalweges essentiell. So dient Mangan als Kofaktor der Insulinsynthese und -sekretion. Magnesium und Chrom unterstützen die Bildung und Funktion des Insulinrezeptors.
- Diuretika-Gaben gehen oft mit Mineralstoffverlusten einher. Auch Zink mit seinen vielfältigen Funktionen ist bei Diabetikern häufig nicht ausreichend vorhanden.
- Statine können die Spiegel an Selen und Coenzym Q10 senken und daher oxidativen Stress verstärken, der sowohl arteriosklerotische als auch neurodegenerative Veränderungen fördert.
- Omega-3-Fettsäuren sind notwendig für die Regeneration von Nervenzellen. Alpha-Liponsäure als potentes Antioxidans und natürlicher Metallchelator kann in der Prävention von Diabetes-assoziierten Neuropathien eingesetzt werden.
- Die Entstehung neuropathischer Veränderungen wird auch durch den bei Diabetikern häufigen Vitamin B1-Mangel gefördert, da Vitamin B1 am Aufbau von Myelin und an der Regeneration von Nervenzellen beteiligt ist. Die neuronale Regeneration wird ferner von Vitamin B12 unterstützt, das bei Einnahme von Metformin häufig defizient ist.
- Gleichzeitig blockiert Metformin den Komplex I der mitochondrialen Atmungskette und hemmt dadurch die ATP-Synthese. Zur Verbesserung der Mitochondrienfunktion sollte daher an eine ausreichende Versorgung mit Vitamin B3 und Coenzym Q10 gedacht werden.
Zur Untersuchung der spezifisch bei Typ II Diabetes wichtigen Mikronährstoffe werden wir zukünftig auf dem neuen, 6-seitigen Anforderungsschein das Profil „Vitalstoffe Diabetes“ anbieten (Profilinhalt: HbA1c, freies Vitamin D, Vitamin B1, B3, B12 bioaktiv, Q10, Alpha-Liponsäure, Carnitin, Chrom, Magnesium, Mangan, Selen, Zink). Ferner empfehlen wir Homocystein sowie die Fettsäuren der Erytrozytenmembran zu bestimmen. Bis zur Verfügbarkeit des 6-seitigen Scheines (Mitte März 2020) bitten wir Sie, die Profilinhalte einzeln anzufordern.
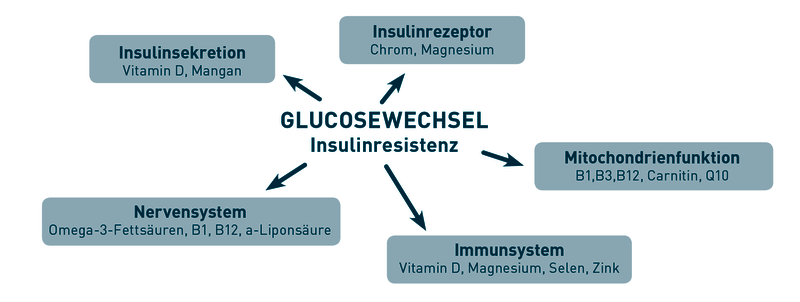
„Eisen im Vollblut“ eignet sich genauso wenig wie Eisen im Serum zur Beurteilung des Eisenstatus. Das im EDTA- oder Heparinvollblut gemessene Eisen stammt zu 99 % aus dem Hämoglobin – seine Aussagekraft ist daher nicht besser als die des Hb-Wertes. Dieser ist aufgrund der 3-monatigen Lebensdauer der Erythrozyten nicht geeignet, Unterversorgungen mit verfügbarem Eisen frühzeitig zu erkennen. Ein Abfall des Hb und des Vollblut-Eisens wird erst bei einer Eisenmangelanämie beobachtet, also bei fortgeschrittenem, klinisch manifestem Eisenmangel. Die Messung von Eisen in der Vollblutmineralanalyse birgt die Gefahr, dass die Eisenzufuhr anhand dieses wenig sensitiven Parameters beurteilt wird und Defizienzen unerkannt bleiben. Aus diesem medizinischen Grund haben wir uns entschieden, Eisen nicht in den Mineralstoffprofilen des IMD mit zu messen, auch wenn es methodisch ganz und gar unproblematisch wäre. Zur verlässlichen und sensitiven Kontrolle der Eisenversorgung empfehlen wir stattdessen die Anforderungen Ferritin, hsCRP, löslicher Transferrinrezeptor und Ferritinindex (auch als Kassenleistung möglich). Der Ferritinindex wird aus Ferritin und dem löslichen Transferrinrezeptor errechnet und ermöglicht die Beurteilung des Eisenstatus auch bei entzündungsbedingtem Ferritinanstieg. Ausführliche Hintergründe zur Diagnostik des Eisenstoffwechsels finden Sie in unserer Diagnostikinformation.
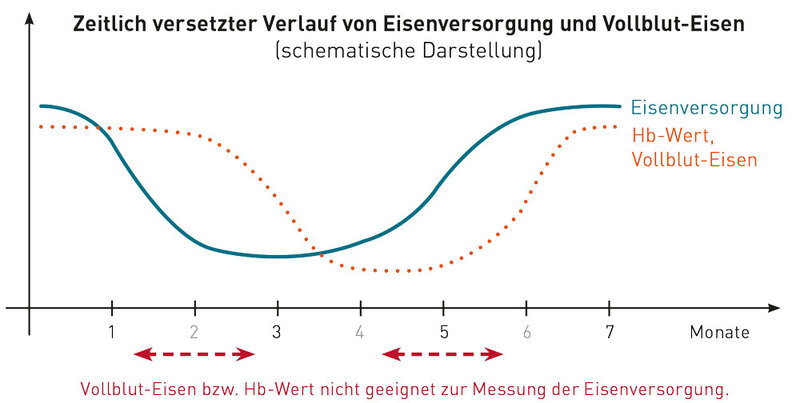
Ja. Die aktuellen Klassifikationskriterien der rheumatoiden Arthritis beruhen auf einem Punktesystem, in dem neben klinischen Symptomen auch Laborparameter berücksichtigt werden. So gehen Entzündungsparameter (erhöhte Blut-körperchensenkungsgeschwindigkeit oder erhöhtes CRP) mit einem Punkt in den Klassifikationsscore ein. Die krankheitsassoziierten Antikörper Rheumafaktor und anti-CCP werden bei einer moderaten Erhöhung (unterhalb des Dreifachen der oberen Referenzbereichsgrenze) mit 2 und bei einer starken Erhöhung (mindestens dreifach über der oberen Referenzbereichsgrenze) mit 3 Punkten bewertet. Hierbei ist es nicht erforderlich, dass beide Marker erhöht sind, für die Klassifikation reicht bereits die Erhöhung eines der beiden Marker. Oft verhalten sich die Marker bei Patienten unterschiedlich, also Rheumafaktor erhöht und CCP normal oder umgekehrt. Mit der Bestimmung von nur einem der beiden Marker kann daher eine RA nicht sicher ausgeschlossen werden.
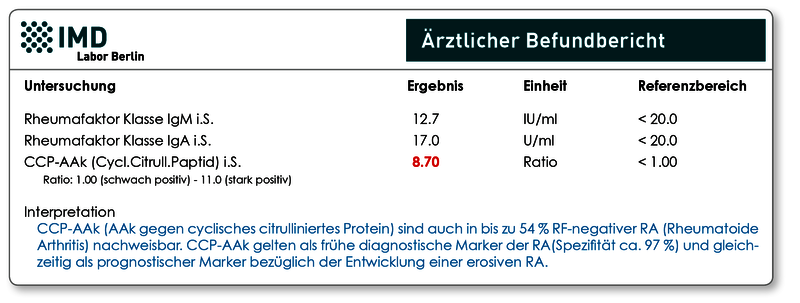
Abb.: Das Befundbeispiel zeigt einen Patienten mit fehlendem Nachweis von Rheumafaktoren, aber einem deutlich erhöhten anti-CCP-Wert. Dieser liegt dreifach über der oberen Grenze des Referenzwertes und geht daher mit 3 Punkten in den Klassifikationsscore der rheumatoiden Arthritis ein
Dies ist durch ihre unterschiedliche Regulation bedingt. Zonulin ist ein Protein, welches zur entzündungsassoziierten Properdin-Familie gehört. Es wird von Darmepithelzellen des Dünndarms sezerniert und ist selbst an der Öffnung der tight junctions und somit an der Erhöhung der Durchlässigkeit des Darmepithels beteiligt. Voraussetzung für die Sekretion von Zonulin sind 1. ein inflammatorisches Signal (Entzündung) und 2. eine Mindestmenge an intakten Darmepithelzellen, die noch Zonulin produzieren können. I-FABP (intestinal- fatty acid binding protein) liegt hingegen präformiert in den Mikrovilli der Darmepithelien vor. Es ist nicht inflammatorisch kontrolliert. Seine originäre Aufgabe ist die Durchschleusung von aus der Nahrung aufgenommenen Fettsäuren durch die Darmepithelzelle. I-FABP wird bei jeglicher struktureller Schädigung des Darmepithels passiv freigesetzt und tritt dann ins Blut über. Die genannten Unterschiede bewirken, dass Zonulin vorrangig in der Initialphase entzündlich bedingter intestinaler Veränderungen hochreguliert wird, während es sich in der chronischen Phase normalisieren kann, wenn das Darmepithel funktionell schon beeinträchtigt ist. In der späteren Phase scheint I-FABP Sensitivitätsvorteile zu haben, wie auch bei allen nicht-entzündungsbedingten Darmepithelschädigungen, z.B. bei Mangeldurchblutung (auch Stress-bedingt, z.B. gezeigt nach Fahrradergometerbelastung) oder bei toxisch bedingtem leaky gut (nach Antibiotikatherapie, toxischer Metallbelastung). Interessant sind Arbeiten, die bei Patienten mit AIDS-Erkrankungen und auch Depression zeigen, dass mit fortschreitender bzw. schwerwiegenderer Erkrankung I-FABP ansteigt und Zonulin eher abfällt. Während dies bei AIDS-Patienten noch dadurch zu erklären ist, dass das Darmepithel bei Erkrankungsprogression schwerer in Mitleidenschaft gezogen ist, wird für die diskrepanten Veränderungen bei Depression der regulierende Einfluss des vegetativen Nervensystems diskutiert.
Unsere bisherigen Ergebnisse zeigen, dass zwischen beiden Markern keine Korrelation besteht, so dass beide Marker unabhängig voneinander ein leaky gut anzeigen können.
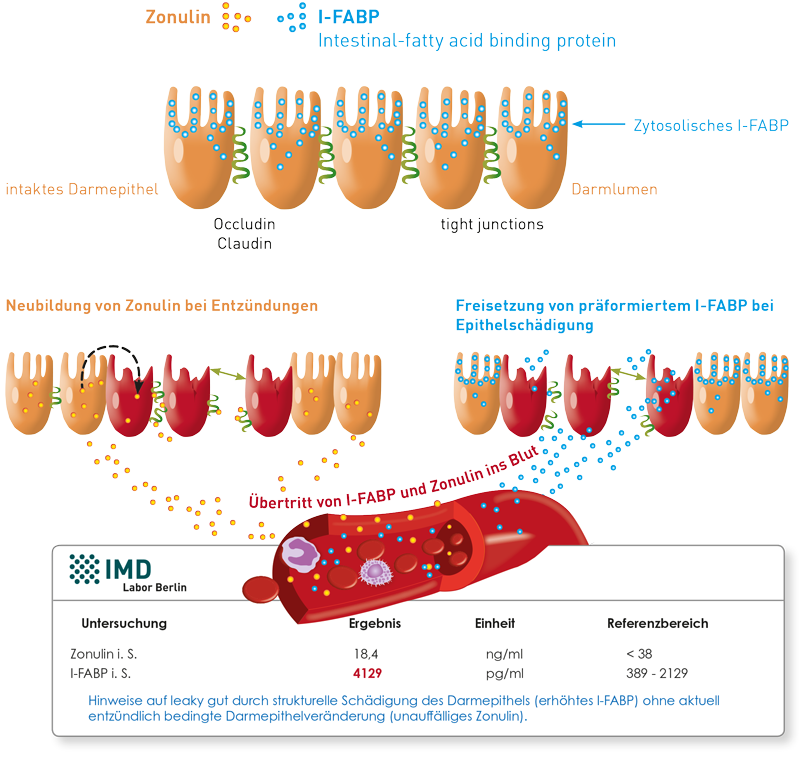
Durch eine Impfung soll unsere körpereigene Abwehr ein immunologisches Gedächtnis gegen einen bestimmten Krankheitserreger aufbauen. Grundlage dafür ist, dass der Impfstoff im Körper eine spezifische Immunreaktion auslöst. Diese kann lokal zu klassischen Symptomen wie Schwellung, Schmerzen und Rötungen führen sowie auch systemisch zu allgemeinem Krankheitsgefühl mit Fieber und Gliederschmerzen.
Unter sogenannten „Impfkomplikationen“ werden hingegen schwerwiegende Reaktionen des Körpers verstanden, die nicht wie die üblichen zuvor genannten Symptome nach wenigen Tagen problemlos abklingen und sogar gesundheitliche Schäden verursachen können (Impfschaden). Ebenso wie jegliche Immunreaktion auf einen Infektionserreger, können solche Impfkomplikationen mit keinem Labortest vorhergesagt werden.
Allerdings kann eine bestehende Unverträglichkeit in Form einer Allergie auf einen Impfstoffbestandteil eruiert werden. Generell stellen aber allergische Reaktionen auf Impfstoffbestandteile eine eher seltene Ursache von Impfkomplikationen dar.
Besteht der Verdacht auf eine Typ-I-Allergie (Soforttyp), bzw. ist bereits eine Typ-I-Allergie auf einen potentiellen Impfstoffbestandteil bekannt, so kann hier der Basophilen-Degranulationstest (BDT) angewendet werden. In diesem „in-vitro-Provokationstest“ werden die patienteneigenen Basophilen Granulozyten mit dem eingesandten Impfstoff konfrontiert und eine daraufhin vermehrte Freisetzung von Leukotrienen kann eine individuelle Sensibilisierung nachweisen.
Auch sogenannte Spättyp-Reaktionen (Typ-IV) können nachgewiesen werden. Hier kommt der Lymphozytentransformationstest (LTT) zum Einsatz. Bei bereits erfolgter früherer Immunisierung ist eine Unverträglichkeitstestung mittels LTT auf den entsprechenden Impfstoff nicht mehr sinnvoll. Hier kann dann nicht mehr zwischen einer bestehenden und durch die Impfung erwünschten zellulären Gedächtnisantwort auf das Impfantigen und einer Typ-IV-Sensibilisierung auf einen Impfstoffbestandteil unterschieden werden! In einem solchen Fall wäre die einzelne Testung auf die jeweils verdächtigen Zusatz- bzw. Beistoffe ratsam.
Es ist zu beachten, dass sowohl der LTT, als auch der BDT lediglich bestehende Sensibilisierungen nachweisen können und keine Vorhersage über sich zukünftig entwickelnde Allergien erlauben.
Die folgende Abbildung soll den Einsatz solch zellulärer in vitro Allergietests im Fall von Impfstoffen nochmal zusammenfassen und verdeutlichen.
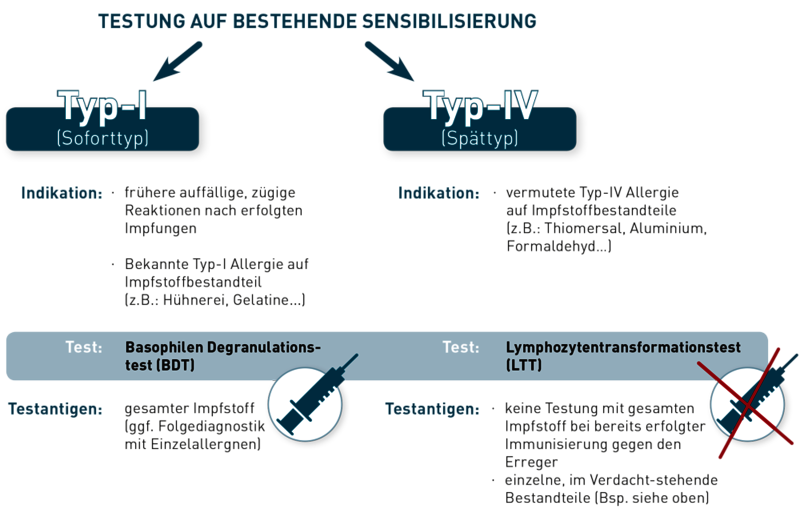
Der Hauptgrund ist, dass nur die reduzierte Form (GSH) intrazellulär bestimmbar ist. Die oxidierte Form (also GSSG) kann man dagegen nicht in Leukozyten sondern nur im Serum (oder lysiertem Erythrozytenkondensat) bestimmen, was aufgrund der intrazellulären Bedeutung wenig Sinn macht. Wir halten (abgesehen von akademischen Fragen) die reduzierte Form intrazellulär in Leukozyten echten gemessen für ausreichend, denn daran wird man immer den Substitutionsbedarf festmachen. Zudem hat die parallele Bestimmung in Monozyten und Lymphozyten eine entscheidende Zusatzaussage. Da Monozyten, nachdem sie aus dem Knochenmark übergetreten sind, nur 24-48 h im Blut zirkulieren und nach Auswanderung nie zurück ins Blut rezirkulieren, ist ein nachweisbarer GSH-Mangel in Monozyten immer Hinweis auf Synthesemängel (Synthesemängel oder Mangel an SH-Gruppen spendenden Aminosäuren) oder GSH-Verlust (Ausscheidung schadstoffkonjugierter GSH-Moleküle über die Niere). Wenn dagegen auch die Lymphozyten als zwischen Gewebe und Blut permanent rezirkulierende Zellen betroffen sind, dann spricht das für einen GSH-Verbrauch (z.B. durch entzündliche Prozesse oder toxische (Über)belastungen. Das intrazelluläre GSH hat zwei wichtige Funktionen. Zum einen dient GSH als Redox-Puffer, d.h. es hilft, zelluläre Proteine und Membranlipide vor „freien Radikalen“ zu schützen. Dabei wird Glutathion oxidiert und geht von seiner monomeren Form GSH in das Dimer GSSG über. Die zweite Funktion ist die Biotransformation von Schadstoffen in der Phase-II-Entgiftung. Dabei katalysiert die zytosolisch lokalisierte Glutathion-S-Transferase die Reaktion von GSH mit Halogen-, Sulfat-, Sulfonat-, Phosphat- und Nitro-Gruppen aber auch Metallionen. Mit GSH konjugierte Stoffe sind wasserlöslich und werden über die Niere und auch biliär besser ausgeschieden. Das so „verbrauchte“ GSH würde sich nicht im Anstieg von GSSG wiederspiegeln. Daher wird deutlich, dass GSSG nur für seine Funktion als Redox-Puffer eine Aussage liefern würde, selbst wenn man es intrazellulär bestimmen könnte.
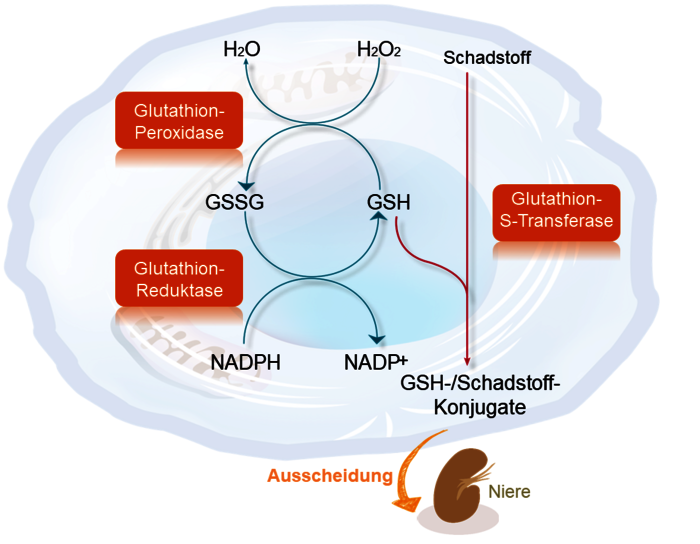

Wie bei allen Säugetieren sinkt auch beim Menschen die Produktion des Milchzucker (Laktose)-spaltenden Enzyms Laktase nach dem Abstillen. In Populationen, die Milchwirtschaft betreiben, sind vor ca. 7500 Jahren schützende Genveränderungen entstanden, die dem Träger eine lebenslange Laktase-Persistenz sichern. So ist in Europa als Anpassung an den lebenslangen Verzehr von Milchprodukten im Laktase-Gen an der Stelle-13910 ein Cytosin (C = Laktaseproduktion nimmt ab) gegen ein Thymidin (T= Laktasepersistenz) ausgetauscht worden. Bei Menschen, die diese schützende Genveränderung nicht tragen, nimmt die Laktase-Produktion im Laufe des Lebens ab, und es entsteht eine primär adulte Laktoseintoleranz. Dies betrifft in Mitteleuropa etwa 15-20 % der Bevölkerung.
Parallel zur europäischen Entwicklung hat auch in anderen Regionen eine Anpassung an den lebenslangen Verzehr von Milchzucker stattgefunden. Auf dem afrikanischen Kontinent sind die folgenden mit Laktase-Persistenz einhergehenden Varianten im Laktase-Gen entstanden: C-13907G, C-13908T, C-13909A, C-13913T, G-13914A und T-13915G.
Die Bezeichnung „afrikanische“ Mutationen bezieht sich darauf, dass diese Genvarianten während der Evolution erstmals in Afrika auftraten. Das bedeutet jedoch keinesfalls, dass sie in der heutigen Zeit nur bei Afrikanern vorkommen. Bereits durch vorgeschichtliche Völkerwanderungen haben sich die Varianten des Laktase-Gens „verteilt“. Sie treten in ca. 8 % der Fälle auf, die in unserem Labor untersucht werden. Diese zusätzlichen Mutationen können also auch Patienten tragen, deren Familien keine Wurzeln in Afrika haben.
Routinemäßig wird am IMD zunächst die häufigere kaukasische Variante C-13910T untersucht. Liegt diese schützende Mutation vor, ist eine primär adulte Laktoseintoleranz ausgeschlossen. Bei Patienten, die diese Genvariante nicht tragen, erkennt die angewandte Technik, ob andere schützende Mutationen in der Genregion vorliegen. Diese werden dann mittels Sequenzierung ausdifferenziert. Das hat die Konsequenz, dass bei 8 % der Patienten eine andere schützende Mutation (=Laktase-Persistenz) festgestellt werden kann. Bei diesen Patienten ist dann ebenfalls eine primär adulte Laktoseintoleranz ausgeschlossen, was den Befundbericht grundlegend ändert. Diese Patienten hätten ohne die Untersuchung auf die afrikanische Variante fälschlich den Befund erhalten, dass keine schützende Mutation und somit eine primär adulte Laktoseintoleranz vorliegt.
Die herkömmliche Blutspiegelanalyse von Vitamin K2 ist aus präanalytischen Gründen und wegen der starken nahrungsabhängigen Schwankungen ungeeignet, um die Vitamin K2-Versorgung einzuschätzen. Ein erhöhtes ucOsteocalcin zeigt einen Mangel an Vitamin K2 besser an. Der Anstieg des ucOsteocalcins beruht dabei darauf, dass K2-Mangel die Carboxylierung des ucOsteocalcins hemmt. Aus diesem Grund steigt bei Vitamin K2-Mangel das untercarboxylierte („uc“) Osteocalcin im Blut an und ist stabil messbar.
Ein normwertiges oder vermindertes ucOsteocalcin zeigt eine ausreichende Versorgung mit Vitamin K2 an. In den seltenen Fällen eines verminderten ucOsteocalcins empfiehlt sich eine weiterführende Diagnostik:
• Mögliche Ursache für erniedrige Werte ist eine Störung des Knochenstoffwechsels, z. B. aufgrund von Vitamin D-Mangel, denn Vitamin D aktiviert die Sekretion von ucOsteocalcin aus den knochenbildenden Osteoblasten.
• Alternativ könnte Vitamin K2 besonders hohe Aktivität haben, so dass die Carboxylierung vermehrt

Die molekulare oder auch komponentenbasierte Allergiediagnostik identifiziert nicht nur die Allergenquelle, sondern die für die Sensibilisierung relevanten Proteinmoleküle (= „Komponenten“).
Die Komponenten werden auf Grundlage von strukturellen Ähnlichkeiten in verschiedene Familien unterteilt. Die Zuordnung der Sensibilisierung eines Patienten zur auslösenden Allergenfamilie ist klinisch relevant. So bedingt im Falle der Erdnuss die Sensibilisierung auf die Speicherproteine (z. B. Ara h 1,2,3) ein erhöhtes Risiko für schwere allergische Reaktionen, während eine alleinige Sensibilisierung auf das PR10-Protein Ara h 8 eine birkenpollenassoziierte Sensibilisierung anzeigt, die in erster Linie mit oralen allergischen Symptomen verbunden ist. Gerade bei Pollenallergikern ermöglicht die komponentenbasierte Diagnostik eine Differenzierung spezifischer Pollensensibilisierungen von Kreuzreaktivitäten mit Nahrungsmitteln, Kräuter- oder Baumpollen (Abb 1).
Eine Einzeltestung bestimmter Allergenkomponenten ist mit dem RAST (UniCAP-Test) möglich. Für polysensibilisierte Patienten mit einem komplexen klinischem Bild bietet sich als kosteneffiziente Alternative das ALEX IgE-Allergenscreening an, welches 125 Allergenkomponenten und 175 Allergenextrakte erfasst. Dieses kann auch zusätzliche Informationen über Sensibilisierungen liefern, die unterhalb der Symptomschwelle liegen und somit durch die Anamnese nicht erfasst werden, jedoch zum atopischen Gesamtbild entscheidend beitragen können (Abb. 2).

Leaky gut (engl. durchlässiger Darm) bedeutet, dass die Barrierefunktion der Darmschleimhaut im Bereich des Dünndarms gestört ist. Die Behandlung des leaky gut stellt eine wichtige Säule in der Therapie chronisch entzündlicher Erkrankungen dar. Sowohl zur Diagnosestellung als auch zur Therapiekontrolle sind non-invasive Labormarker wichtig. Als Referenzmethode gilt der Laktulose/ Mannitol-Quotient, der aber wegen des Aufwandes kaum praktikabel ist. Vielfach genutzt werden die Stuhlmarker α1-Antitrypsin, sIgA und Calprotectin, wobei die letzten beiden streng genommen eher Entzündungsmarker sind, weshalb sie bei Ischämie-, Stressoder toxisch bedingtem leaky gut kaum ansteigen. Ein in der Vergangenheit häufig verwendeter Blutmarker ist das Zonulin, ein von Enterozyten sezerniertes Protein, welches für die Öffnung der tight junctions verantwortlich ist. Allerdings kann bei schwerer Schädigung des Darmepithels wegen der in geschädigten Enterozyten gestörten Zonulinproduktion ein Zonulinanstieg auch ausbleiben. Bei Patienten mit Depression ist das Plasma-Zonulin sogar vermindert trotz erhöhtem I-FABP und zwar am niedrigsten bei den Patienten mit hohem Symptomscore. Ein Anstieg des Zonulins im Stuhl oder Blut ist, erklärbar durch dessen regulative Funktion, an eine „normale“ Darmfunktion gebunden. Das erklärt auch, dass es manchmal unter Therapie zum Anstieg des Zonulins kommt.
Wir empfehlen, I-FABP im Serum zu messen. Das Intestinal-fatty acid binding protein I-FABP ist hochspezifisch für Darmepithelien. Es wird im oberen Teil der Villi in reifen Enterozyten des Dünndarms exprimiert und bei morphologischer oder funktioneller Enterozytenschädigung in den Blutkreislauf freigesetzt. Der I-FABP-Serumspiegel korreliert nachweislich zur Pathologie und zur Laktulose/ Mannitol-Ratio. Erhöhte Werte und eine Korrelation zu den Symptomscores wurden nachgewiesen bei Zöliakie, Nicht-Zöliakie-Weizensensitivität, Mesenterialinfarkt, Nekrotisierender Colitis, Depression und auch schwerer körperlicher Belastung (Leistungssport). Wegen seiner kurzen Halbwertszeit ist I-FABP sehr gut zur Therapiekontrolle geeignet.

Endotoxine (Synonym: Lipopolysaccharide LPS) sind Bestandteile der Zellwand gramnegativer Bakterien. Es ist richtig, dass bei gestörter Darmpermeabilität von den Darmbakterien herrührende Endotoxine vermehrt über die Darmwand aufgenommen werden. Der Darm wird aber bekanntlich durch die Venen des Pfortadersystems drainiert. Das Pfortaderblut passiert initial die Leber, wo je nach Leberfunktion zwischen 95 und 99 % des Endotoxins schon bei der ersten Passage eliminiert werden („first pass effect“). Bis zur Blutabnahme aus der Armvene passiert das Blut noch die rechte Herzkammer, die Lunge, die linke Herzkammer und dann auch noch das gesamte arterielle Kapillarbett der Körperperipherie. Deshalb lässt der peripher-venöse Endotoxinspiegel keinen Rückschluss auf die Translokation im Darm zu. Um tatsächlich auf das im Darm translozierte Endotoxin rückzuschließen, müsste man das Blut aus der Pfortader entnehmen, was nicht möglich ist. Die Blutabnahme aus der Armvene kommt sprichwörtlich zu spät (siehe Abbildung). Ebenfalls ungeeignet zur Feststellung einer systemischen Endotoxinbelastung ist die Bestimmung der LPS-Antikörper. Die Bildung der Antikörper gegen die Endotoxinmoleküle ist variabel und wird mehr durch individuelle Antikörperbildung und -abbau beeinflusst, als durch die Menge an aufgenommenem oder zirkulierendem Endotoxin.
Für den Nachweis der systemischen Entzündung stehen heute hochsensitiv messbare Zytokine zur Verfügung (TNF-α, IL-1, IL-6). Die gestörte Darmpermeabilität kann über das Zonulin im Serum oder auch alpha-1-Antitrypsin im Stuhl erfasst werden.

Dass in Einzelfällen 20 ml Heparinblut nicht ausreichen, liegt daran, dass der Lymphozytentransformationstest (LTT) nicht mit Vollblut durchgeführt wird, sondern dass aus dem Patientenblut Lymphozyten und Monozyten (sogenannte Mononukleäre Zellen) isoliert werden. Hier lassen sich mal mehr und mal weniger Zellen gewinnen. Beim LTT werden pro Allergen ca. 600.000 Mononukleäre Zellen benötigt. Um eine perfekte Sensitivität sicherzustellen, machen wir hier keine Abstriche. Die Isolationsausbeute, d. h. die Zahl der vitalen Lymphozyten, die gewonnen werden kann, hängt davon ab, wie viele Lymphozyten der Patient im Blut hat. Bei deutlicher Lymphozytopenie kann es knapp werden. Manchmal ist aber auch die Qualität der Zellen ausschlaggebend, denn nur intakte und vitale Einzelzellen gehen in die Ausbeute ein. Bei Erkrankungen, die mit Immunaktivierung einhergehen, kann es in seltenen Fällen dazu kommen, dass durch Migration der Immunzellen ins Gewebe ihre Zahl im Blut abnimmt. Auch eine unzulässige Probenkühlung während des Transports ins Labor kann die Zellzahl deutlich reduzieren. Einige Medikamente können ebenfalls diesen Effekt verursachen. Deshalb empfehlen wir im Winter nicht nur einen kontrollierten temperierten Bluttransport per Kurier (keine Posteinsendung!) sondern auch, wenn möglich, ein Röhrchen Heparinblut mehr einzusenden. Das gibt dem Labor eine Reserve, falls diese nötig wird.

Wir empfehlen die „Folsäure bioaktiv“. Bereits die Bezeichnung „intrazellulär“ ist grundsätzlich irreführend, da hier in den Laboren lediglich der Blutkuchen untersucht wird. Dieser besteht zu 99 % aus Erythrozyten, die als „Transporthüllen“ des Hämoglobins weder über Zellkern noch über Mitochondrien und andere Organellen verfügen. Ihr Stoffwechsel und ihr Bedarf an Mikronährstoffen sind daher nicht mit echten Zellen gleichzusetzen. Richtig wäre, wenn man die Analyse „Folsäure intraerythrozytär“ nennen würde. Ferner misst die Erythrozyten-Analyse analog zur konventionellen Serumanalyse lediglich die Folsäure-Konzentration. Die Konzentrationsbestimmung erfasst dabei üblicherweise die Folsäure und zwei Folsäure-Metabolite (5-Methyl- und 5-Formyl-Tetrahydrofolat).
Daher erfasst die Spiegelbestimmung (in Erythrozyten wie im Serum) weder die zahlreichen weiteren bioaktiven Folsäure-Metabolite noch ihre anteilige Verteilung. So kann ein geringer Anteil an 5-Methyl-THF dazu führen, dass trotz normwertigem Spiegel die Folsäure-Bioaktivität vermindert ist (siehe Abbildung). Nur bei ausreichender Bioaktivität steht jedoch „Folsäure“ als Mikronährstoff dem Stoffwechsel in ausreichender Menge zu Verfügung.
Es ist bisher keine Methode verfügbar, Folsäure-Bioaktivität in Erythrozyten zu messen – oder gar in Leukozyten, die als echte Zellen repräsentativer für Körperzellen wären. Deshalb empfehlen wir die Bestimmung der „bioaktiven Folsäure im Serum“ als den derzeit aussagefähigsten Marker für den Folsäure-Status (Analyse 106, Schein „Spezielle Immunologie“).

Nein, als globaler „Einstiegstest für Autoimmunerkrankungen“ ist der ANA-Nachweis nicht geeignet. ANA weisen eine hohe Sensitivität für systemische rheumatische Erkrankungen (Kollagenosen) auf und gelten als Diagnosekriterium für Kollagenosen, nicht jedoch für andere Autoimmunerkrankungen. Zudem finden sich ANA auch bei zahlreichen anderen entzündlichen Prozessen, Tumoren sowie passager im Rahmen von Infektionserkrankungen. Sogar bei Gesunden sind ANA gelegentlich nachweisbar, wenn auch mit niedrigem Titer, mit steigender Prävalenz im Alter > 60 Jahre. Bei Verdacht auf eine Kollagenose kann die Krankheitsspezifität erst durch die ANA-Differenzierung ermittelt werden, wie z. B. Autoantikörper gegen SS-A(Ro) und SS-B(La) bei Sjögren-Syndrom (siehe Befundbeispiel). Bei Verdacht auf andere systemische oder organspezifische Autoimmunerkrankungen, wie z. B. rheumatoide Arthritis, Schilddrüsenerkrankung, Diabetes mellitus Typ 1 oder Zöliakie, sollten daher die entsprechenden diagnostisch relevanten Autoantikörper bestimmt werden (siehe Anforderungsschein „Spezielle Immundiagnostik“ Analysen 281-342). Die zusätzliche Bestimmung der ANA ist zur Differentialdiagnostik durchaus empfohlen, da die Kollagenosen mit verschiedenen Organmanifestationen einhergehen können.

Vitamin B1, B2 und B6 entfalten ihre Wirksamkeit erst nach ihrer Umwandlung in Thiamin-, Riboflavin- und Pyridoxal-Phosphate. Diese Biotransformation geschieht enzymatisch über die Anlagerung von Phosphaten mit Hilfe verschiedener Phosphokinasen. Der Anstieg der Bioaktivität hängt damit nicht allein von der supplementierten Dosis ab, sondern auch von der Effizienz der Biotransformation. Die zentralen Enzyme, so genannte Phosphokinasen, weisen eine individuell unterschiedliche Aktivität auf, wozu vermutlich genetische Faktoren beitragen. Gleichzeitig wird die Rate der Biotransformation durch die Verfügbarkeit von Spurenelementen beeinflusst, insbesondere von Zink, Magnesium und Kalium.
Hinzu kommt, dass in Abhängigkeit der Aktivität einzelner Stoffwechselprozesse die verfügbaren B-Vitamine unterschiedlich stark „verbraucht“ werden. Diese Vitamin-abhängigen Vorgänge werden durch Supplementierung unterstützt und oft beschleunigt. Zum Beispiel braucht die Pyruvatdehydrogenase Vitamin B1, verschiedene Schritte des Zitratzyklus wiederum benötigen die Vitamine B2 und B6. Die erfolgreiche Behandlung eines Nitrosativen Stress (erkennbar am Abfall des Nitrotyrosins im Blut) steigert z. B. die Aktivität der Pyruvatdehydrogenase und damit sekundär den Bedarf an Vitamin B1.
Der oben genannte Verlauf könnte damit erklärt werden, dass verabreichtes Vitamin B6 mit Hilfe von Zink, Magnesium, ATP und Vitamin B2 zu aktiven Vitamin B6-Formen metabolisiert wird. Die Biotransformation von Vitamin B6, vor allem über das Enzym Pyridoxin 5‘-phosphatoxidase, verbraucht also Vitamin B2. Daher kann es durch den substitutionsgeförderten Anstieg der Vitamin B6-Aktivität vorübergehend zu einem Abfall des bioaktiven Vitamin B2 kommen. In seltenen Fällen geschieht dies auch bei Supplementierung mit Pyridoxal-5-Phosphat (P-5-P) – dann vermutlich aufgrund unvollständiger Phosphatierung bzw. Oxidierung des Supplements. Häufig ist jedoch ein schnellerer Anstieg des bioaktiven Vitamin B6 zu beobachten, wenn P-5-P verwendet wird.

Bei Verdacht auf Schimmelpilzallergie vom Typ I oder Typ IV nutzen viele Umweltmediziner die Möglichkeit, direkt auf die im Wohnumfeld des Patienten angezüchteten Schimmelpilze zu testen. Das ist sowohl im Lymphozytentransformationstest (LTT) als auch im Basophilen-Degranulationstest (BDT) möglich. Der Vorteil ist, dass man so für den betreffenden Patienten eine klare Aussage machen kann, ob er auf irgendeinen in seinem Umfeld vorhandenen Pilz allergisch reagiert. Bei der Vielzahl möglicher Spezies und dem eingeschränkten Spektrum der Standardallergiediagnostik ist dieses sehr hilfreich. Bei einem positiven Befund in den Nativ-Allergietests ist es nachgewiesen, dass das häusliche Umfeld des Patienten für ihn eine individuell relevante Schimmelpilz-allergene Belastungsquelle darstellt.
Diese Anzuchtplatten bzw. die darauf gewachsenen Schimmelpilze eignen sich dagegen nicht für die mykologische Differenzierung, also die taxonomische Bestimmung der gewachsenen Schimmelpilze. Dafür wäre eine standardisierte Probensammlung essentiell. Mit dem für die Allergietestung etablierten „Sammelverfahren“ durch bloßes Aufstellen der geöffneten Platten, können keine quantitativen Rückschlüsse gezogen werden, und es kann daher nicht zwischen mengenmäßig relevanten und irrelevanten Belastungen unterschieden werden. Das Ausmaß des Bewuchses der Sabouraud-Agar-Platten ist eher vom Wachstumsverhalten abhängig als vom ursprünglichen Sporeneintrag auf der Platte. Obwohl technisch möglich, wäre daher die Bestimmung der Schimmelpilzkolonien auf diesen Platten vor Vermietern, Gerichten oder Behörden, trotz hoher Kosten, wertlos. Die Probensammlung, die Anzucht sowie die Differenzierung muss auf die baubiologischen Fragestellungen angepasst sein und sollte deshalb durch einen Sachverständigen oder Baubiologen erfolgen.

Antihistaminika wie z. B. Cetirizin und Loratadin sind Wirkstoffe, welche die Wirkung körpereigenen Histamins abschwächen oder aufheben, indem sie Histamin-Rezeptoren blockieren. Sie beeinflussen jedoch nicht die Freisetzung und den Abbau des Histamins und wirken sich damit nicht auf den Histaminspiegel im Blut aus.
Bei Typ-I-Allergikern ist in erster Linie die Freisetzung des Histamins durch Mastzellen für die bekannte Symptomatik verantwortlich. Da ein hautbasierter Allergietest (z. B. Prick-Test) auf der Grundlage der durch Histamin ausgelösten Hautreaktion beruht, sind die Medikamente in diesem Fall wenigstens 48 Stunden vor Durchführung des Testes abzusetzen.
Auf die Labordiagnostik hingegen haben Antihistaminika aus folgenden Gründen keinen Einfluss:
- Im RAST werden allergen-spezifische IgE-Antikörper bestimmt, diese Diagnostik ist Histamin unabhängig.
- Im BDT kann die allergen-induzierte Histamin- und/oder Leukotrienfreisetzung problemlos bestimmt werden, da Antihistaminika als Histaminrezeptorenblocker lediglich die Wirkung des Histamins an deren Zielzellen blockieren, nicht aber die Aktivierung oder die Funktionalität der basophilen Granulozyten (siehe Abbildung unten)
- Im LTT wird zum Nachweis der Typ-IV-Allergie die Vermehrung antigen-spezifischen T-Lymphozyten bestimmt, auch diese ist Histaminrezeptor-unabhängig.

VEGF (Vascular Endothelial Growth Factor) ist ein Signalmolekül in der Angiogenese. Es stimuliert das Wachstum von Blutgefäßendothelien.
Es gibt zwei Indikationen für die Bestimmung beim Patienten:
1. als Progressionsmarker bei Tumorerkrankungen
VEGF stimuliert die Teilung und Migration von Endothelzellen der Blutgefäße und somit auch eine Neovaskularisation von Tumoren. Das erklärt, warum eine höhere VEGF-Expression im Tumor mit einem progressiveren Wachstum solider Tumoren einhergeht. In aktuellen Studien wurde gezeigt, dass auch der im Patientenblut gemessene VEGF-Spiegel prognostische Aussagen macht. Ein Anstieg des VEGF-Serumspiegels im Verlauf, insbesondere unter immunstimulierender Therapie, gilt als kontraproduktiv.
2. zur Differentialdiagnostik der Bartonellose
Die Bestimmung von VEGF im Serum dient dem Nachweis von Bartonella henselae Ko-Infektionen bei Patienten mit Erkrankungen, die durch Zecken übertragen werden. Bartonella henselae induziert in befallenen Zellen VEGF, weshalb erhöhte Blutspiegel einen wichtigen Hinweis auf eine erfolgte Infektion geben. Der Pathomechanismus der VEGF-Bildung durch Bartonellen erklärt sich darüber, dass die sich vermehrenden Bartonellen in den befallenen Körperzellen und Geweben ein Energiedefizit und ATP-Mangel auslösen. Dieses Defizit würde sekundär aber auch für die Bartonellen selbst die Überlebenswahrscheinlichkeit reduzieren. Die Induktion von VEGF durch die Bartonellen und die damit bessere Durchblutung des befallenen Gewebes führt zu einem Überlebensvorteil der Erreger.
Für die Bestimmung von VEGF wird 5 ml Vollblut zur Serumgewinnung benötigt. Das Vollblut muss (sofern es nicht taggleich im Labor eintrifft) in der Praxis abzentrifugiert werden.

Wir empfehlen für die Untersuchung der Spurenelemente immer die Vollblutmineralanalyse (im EDTA- oder Heparin-Vollblut). Sie erfasst die Gesamtheit der Spurenelemente, die über das Blut ans Gewebe verteilt werden. Bei der Vollblutmineralanalyse untersuchen wir das Blut als „Transportmedium“ für die Gewebeversorgung. Die Analytik beantwortet die Frage: Stehen den Organen und Geweben ausreichende Mengen an Mineralstoffen zu Verfügung?
Nicht sinnvoll hingegen ist die Analyse von Mineralstoffen in isolierten Fraktionen des Blutes (PBMCs oder Erythrozyten), wenn es um den Versorgungsstatus des Patienten geht. Es gibt hier z. B. entzündungsabhängige Verschiebungen, die nichts mit dem Versorgungsstatus zu tun haben (u. a. den Einstrom von Calcium – daher messen wir das Calcium in Leukozyten im Rahmen chronisch entzündlicher Veränderungen). Auch eine Gleichsetzung von Erythrozyten mit Gewebezellen ist nicht zulässig – Erythrozyten haben keinen Zellkern und keine Mitochondrien, ihr Stoffwechsel und damit auch ihr Mikronährstoffbedarf ist daher in keiner Weise mit dem Stoffwechsel echter Zellen vergleichbar.
Anders ist das bei den intrazellulär gebildeten Vitalstoffen wie ATP und Glutathion, die im Februar-Newsletter dargestellt wurden. Sie werden nicht wie Spurenelemente über das Blut verteilt, sondern sie werden in allen (echten) Zellen gebildet. Daher bietet ihre Bestimmung in echten Zellen (im Blut wären das die so genannten PBMCs) die Möglichkeit, auf andere Gewebezellen rückzuschließen.

Abb. Die Vollblutmineralanalyse erfasst die Gesamtheit der über das Blut an die Organe verteilten Spurenelemente. Sie ist daher maßgeblich für die Beurteilung des Versorgungsstatus. Im Blut besteht ein Austausch zwischen freien, proteingebundenen und intrazellulären (Erythrozyten, Leukozyten) Spurenelementen.
Für die Beurteilung des Versorgungsstatus und ggf. des Substitutionsbedarfes an Vitalstoffen wie z. B. Spurenelementen, Vitaminen, ATP oder Glutathion ist die Einschätzung der Gewebeversorgung maßgeblich. In der Praxis steht uns jedoch als Untersuchungsmaterial ausschließlich das Blut zu Verfügung. Generell gilt, dass die Aussagekraft der Laborwerte größer ist, wenn man nicht nur die frei im Blutserum enthaltenen Stoffe sondern auch die intrazellulären Anteile erfasst.
Für die Untersuchung der Spurenelemente liefert die Vollblutmineralanalyse die aussagekräftigen Laborwerte, da sie sowohl die intrazellulären Pools als auch den Serumanteil erfasst, der für den Transport in Organe und Gewebe zu Verfügung steht. Die Vollblutmineralanalyse zeigt an, ob für die physiologisch regulierte Verteilung ins Gewebe ausreichend Spurenelemente vorhanden sind.
Andere Vitalstoffe werden nicht an Gewebe und Organe verteilt, sondern in den Zellen gebildet, wie z. B. ATP und Glutathion. Zur Bestimmung ihres Versorgungsstatus sollte deshalb ihr Gehalt auch ausschließlich in Blutzellen gemessen und davon der Versorgungsstatus der Gewebezellen abgeleitet werden.
Dabei wird der Terminus „intrazellulär“ oft missverständlich verwendet. Unter „intrazellulär“ verstehen wir die Bestimmung in Monozyten und Lymphozyten, die auch als PBMC (Peripheral Blood Mononuclear Cells) bezeichnet werden. PBMC sind „echte“ Zellen, da sie über Zellkern und Mitochondrien verfügen und einen Zellstoffwechsel unterhalten. Nur diese echten Blutzellen sind den Gewebezellen ähnlich genug, um von ihrem Gehalt an Vitalstoffen mit ausreichender Genauigkeit auf die Gewebezellen zurückzuschließen. Erythrozyten stellen hingegen im Wesentlichen die „Transporthülle“ für das Hämoglobin dar. Ein Rückschluss von Erythrozyten auf den Vitalstoffgehalt von Organen und Gewebe ist unzulässig.
Es gibt zwei Verfahren zur intrazellulären Messung:
1. Die Lymphozyten und Monozyten werden aus Heparinblut zuerst durch eine Dichtegradientenzentrifugation von den Erythrozyten, Granulozyten und Thrombozyten sowie vom Serum getrennt (siehe Abb.). Wir verwenden diese Methode für die Bestimmung des ATP, sowie für Calcium, Kalium und Magnesium im Rahmen der Vitamin D-Stoffwechsel-Diagnostik nach Dr. Löffler.
2. Bei der zweiten Möglichkeit zur intrazellulären Analyse werden die Lymphozyten und Monozyten durch Zugabe von zellspezifischen monoklonalen Antikörpern zytofluorometrisch von den restlichen Blutzellen und den Erythrozyten getrennt. Die Anwendung dieser Methode ist dann möglich, wenn auch der zu bestimmende Analyt durch intrazelluläre zytofluorometrisch auswertbare Färbung nachweisbar ist. Wir nutzen diese Methode für die Bestimmung von reduziertem Glutathion (GSH).
Irreführend ist es dagegen, wenn solche Analysen als „intrazellulär“ bezeichnet werden, bei denen aus einer EDTA-Blutprobe lediglich nach Zentrifugation das Serum abgetrennt wird und anschließend der gesamte „Blutkuchen“ zur Analyse verwendet wird. Hier wird der Messwert im Wesentlichen durch die zellkernlosen Erythrozyten und die kurzlebigen Granulozyten bestimmt, die kaum eine Aussage über den Gewebegehalt an Vitalstoffen machen können. Auch ist eine vollständige Entfernung des Serums nicht möglich. Richtigerweise sollte diese Methode wegen der Dominanz der roten Blutzellen immer als „intraerythrozytäre“ Analyse gekennzeichnet werden, wobei wir eine Vitalstoffbestimmung in roten Blutzellen für genauso wenig aussagefähig halten wie die Bestimmung im Serum.

Der MELISA ist auch ein LTT. Es handelt sich umeine vor fast 30 Jahren erstmals vorgestellte und damals neuartige methodische Variante des LTT. Genau wie der heutige LTT sollte auch der MELISA nachweisen, ob ein Patient eine Typ IV-Allergie hat, d. h. ob er spezifische T-Lymphozyten gebildet hat,die gegen das jeweilige Allergen gerichtet sind.
Unseres Erachtens sind die vielen positiven MELISA-Ergebnisse auf Titan nicht korrekt. Zumindest handelt es sich keinesfalls um Allergien, wie wir sie von anderen Metallen kennen. Titan ist ein besonderes Metall, weil es auf Grund seiner hohen Oxidierungstendenz im Organismus nicht als eiweißbinden des Ion vorliegt, sondern immer als Oxidpartikel.
Da aber nur Ionen an zelleigene Eiweiße binden und darüber eine Allergisierung auslösen können,ist bei Titan dieser allergieauslösende Hapteneffekt nicht möglich. Positive Stimulationsindizes im MELISA beruhen deshalb nicht auf der Zellteilung Titan-spezifisch-aktivierter T-Lymphozyten, sondern auf einem unspezifisch zellaktivierenden Effekt.
Diese unspezifische T-Zellaktivierung ist beim LTT aber durch die Verwendung geeignet niedriger Stimulationskonzentrationen im Labortest ausgeschlossen.Wir sind uns bewusst, dass Patienten mit bestehenden Beschwerden einen positiven Labortest als überzeugender empfinden, da ein bestehender Verdacht in ihren Augen bestätigt wird. Aus den o.g. Gründen darf aber nicht von einer Titanallergie gesprochen werden.
Wir empfehlen zum Nachweis einer Titanunverträglichkeit den Titanstimulationstest in Kombination mit dem genetischen Entzündungsgrad.
Beide Tests selektieren die Patienten, welche eine verstärkte unspezifische Entzündungsantwort der Gewebemakrophagen auf Titanoxidpartikel zeigen und bei denen vorrangig Alternativmaterialien wie Keramik verwendet werden sollten. Dabei handelt es sich immerhin um ca. 15 % der Bevölkerung. Es ist Spekulation,dass im MELISA-Test indirekt genau diese Patienten auffällig gefunden werden.Entsprechende Studien liegen bisher nicht vor.
Zur Abb.: Bei einer tatsächlichen allergenspezifischen Immunantwort reagieren zwischen 0,1 und maximal 1 % der T-Lymphozyten des Patienten mit monoklonaler Expansion auf das Antigen. Höhere Werte deuten auf eine mitogene Expansion hin.

Soweit derzeit bekannt, bedingt eine erhöhte Entzündungsneigung nur dann eine Titanunverträglichkeit, wenn es durch Abrieb zur Freisetzung von Titanoxidpartikeln kommt. In Folge dieser Partikelablagerung im Gewebe kann es bei Entzündungs-High-Respondern zu einer gesteigerten Fremdkörperreaktion mit der Folge einer primärenlokalen Entzündung und einer verzögerten knöchernen Einheilung kommen. Gut untersucht ist diese Form der „Titanunverträglichkeit“ bei Zahnimplantatenaus Reintitan. Die Hyperreaktivität eines Patienten auf Titanoxidpartikel wird durch den Titanstimulationstest nachgewiesen.
Titanclips bestehen aus Titan/Aluminium/Vanadium-Legierungen (Ti 6Al/4V). Die Abriebstabilität dieser Legierung ist deutlich größer als bei handelsüblichem(nahezu) reinem Titan, wie es z. B. für Zahnimplantate verwendet wird. Zudem kommt es durch das freie Liegen der Titanclips im Muskel oder Fasziengewebe oder in der Blutgefäßwand nicht zu einer signifikanten Oberflächenabreibung (zumindest sofern die Clips einander nicht berühren).Aus den genannten Gründen ist es somit wenig wahrscheinlich, dass Titanoxidpartikel in relevanter Menge aus den Clips freigesetzt werden.Deshalb kann es zumindest über diesen Weg selbst bei Entzündungs-High-Respondern nicht zu lokalen Entzündungsreaktionen kommen. Prinzipiell nicht auszuschließen ist aber, dass es bei Patienten mit Aluminium-, Nickel oder Vanadium-Typ IV Allergie zur Immunreaktion kommt, sofern Metallionen aus der Legierung freigesetzt werden.
Diese Metallionenfreisetzung erscheint vor allem im entzündeten Gewebe möglich. Bei entsprechendem Verdacht empfiehlt sich deshalb hier eher,einen Lymphozytentransformationstest auf die Legierungsbestandteile in den Titanclips durchzuführen.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 210
Der Kreatininbezug hat Vor- und Nachteile. Die kreatininbezogenen Metallwerte (μg/g Krea) sind geeignet, um schwankende Urinkonsistenzen (Diureseeffekte) zu berücksichtigen. Der Kreatininwert hängt aber auch von anderen Faktoren ab wie der Muskelmasse, der Nierenfunktion, Ernährungsgewohnheiten und der Medikamenteneinnahme.
Alle diese Faktoren können das Resultat im Urin verfälschen, wenn man die Messwerte kreatininbezogen darstellt. Bei einem Patienten mit hoher Muskelmasse und damit einhergehendem hohen Serumkreatinin würde man einen hohen Urinmetallwert verharmlosen, da man ihn durcheine Kreatininnormalisierung „runterrechnen“würde.Gleiches gilt für Patienten mit (auch leicht) verminderter Nierenfunktion, was gerade bei metallbelasteten Patienten nicht selten vorkommt. Daher geben wir die Referenzbereiche der Metalle im Urin in der Einheit μg/L an und folgen damit auch den Empfehlungen der WHO und des Umweltbundesamtes.
Anders ist es bei Verlaufsuntersuchungen. Hier müssen dagegen die kreatininbezogenen Metallwerte berücksichtigt werden, da Muskelmasse, Nierenfunktion und andere Einflussfaktoren bei einem Patienten mehr oder weniger als konstant angenommen werden können.

Da Quecksilber keine physiologische Funktion hat, gilt grundsätzlich „je weniger desto besser“. Auch bei geringen Gesamt-Quecksilberspiegeln im Blut ist eine Beeinträchtigung des Spurenelementhaushaltes und der endogenen antioxidativen Kapazität nicht auszuschließen. Erhöhte Spiegel bis etwa 5 μg/L sind noch als leichte Belastungen anzusehen. Für die Einschätzung ihrer Schädlichkeit ist die Belastungsdauer besonders wichtig. Handeltes sich um eine gelegentliche Exposition – zufällig zum Zeitpunkt der Blutuntersuchung – oder resultiert der Messwert aus einer permanent vorhandenen Quelle?
Diese Unterscheidung erfordert neben einer möglichen Kontrolle des Quecksilberwertes (nach etwa drei bis vier Wochen) eine Abklärung der individuellen Essgewohnheiten. Neben Fisch, Muscheln und Meeresfrüchten können auch zahlreiche weitere Lebensmittel mit Quecksilber belastet sein. Eine Studie aus dem Jahr 2014 zeigte z. B., dass der Quecksilbergehalt in Gemüse im Durchschnitt ein Drittel des Gehaltes in Fisch beträgt, Geflügel und anderes Fleisch sogar 70-80 %. Der Belastungsgrad der Agrarprodukte hängt dabei von der Boden- und Umweltbelastung ab. Obst und Gemüsesäfte sowie Weine können in Einzelfällen hohe Quecksilbermengen enthalten, v. a. wenn sie in der Nähe von Fernverkehrsstraßen, Müllverbrennungsanlagen oder Kohlekraftwerken wachsen. Früchte können auch durch quecksilberhaltige Spritzmittel belastet sein, v. a. bei importierten Früchten. Die unmittelbareinhalative Belastung aus Abgasen, Kaminen oder auch über Tonerstäube stellen weitere Belastungsquellen dar.
Eine weitere Ursache geringer, aber konstanter Quecksilberspiegel kann auch der Austausch zwischen Gewebe und Blut sein. Die Quecksilberquelle stellt in diesem Fall der Gewebe-Speicherpool aus früheren Exposition dar. Diese „Quelle“ wäre nur durch eine Chelattherapie (Ausleitung) langsam abzubauen.

Wenn ein Patient ein bestimmtes Metall als Zahnersatz im Mund hat, dann ist eine zumindest geringgradige Freisetzung in den Speichel immer vorhanden. Goldwerte von etwa 70 -100 μg/L messen wir regelmäßig bei Patienten, die Goldlegierungen im Mund haben – es handelt sich um einen deutlich erhöhten, aber nicht extremhohen Wert. Wichtig ist es, die Konzentration auf Anzahl bzw. Menge des eingesetzten Materials zu beziehen: Sind es 10 Kronen, möglicherweise aus einer weichen Goldlegierung? Dann wäre ein Wert von 70 μg/L „erwartungsgemäß“,da er den Eigenschaften und der Menge des verwendeten Materials entspricht.
Oder ist es ein einziges kleines Inlay, aus dem die gemessene Metallmenge frei wird? Dann wäre ein Wert von 70 μg/L ungewöhnlich hoch. Über die Fähigkeit des individuellen Patienten, eine permanente orale Metallexposition dieser Höhe zu kompensieren,kann die Spiegelbestimmung im Speichel keine Aussage treffen. Neben der klinischen Beurteilung spielen hier insbesondere die Darmbarrierefunktion (messbar über das Zonulin im Serum), das antioxidative Schutzsystem (Antioxidantien, Spurenelemente),sowie die Ausscheidungs- und Entgiftungskapazität (Nierenfunktion, Entgiftungsgenetik) eine wichtige Rolle. Um die systemische Belastung zu untersuchen, wäre in diesem Fall die nachfolgende Bestimmung im Blut (EDTA-Blut) sinnvoll. Beibe stehen der Typ IV-Sensibilisierung (messbar im LTT) ist eine Unverträglichkeitsreaktion aber unabhängig von der Höhe der gemessenen Metallkonzentration zu erwarten.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 295, 304
Nein, dazu soll der Test auch nicht dienen. Es kann trotzdem in der bildgebenden Diagnostik (OPG, CT,DVT) eine lokale Entzündung an einem oder mehreren Zähnen nachweisbar sein.
Bei einem gleichzeitig negativen Mercaptane/Thioether-Stimulationstest ist allerdings eine davon ausgehende bzw. durch sie ausgelöste entzündliche„Fernherdwirkung“ unwahrscheinlich.
Im Umkehrschluss deutet ein positiver Test daraufhin, dass ein systemischer entzündlicher Prozess durch den Entzündungsherd im Kieferknochen unterhalten bzw. verstärkt wird. Die Studie von Jacobi-Gresser et al. hat nicht nur die Spezifität der Testaussageunterstrichen, sondern auch gezeigt, dass durch Revision der Wurzelfüllung bzw. Extraktion des betroffenen Zahnes das Laborergebnis signifikant zurückgeht (Jacobi-Gresser et al., J Biol Regul Homeost Agents 2015).
Der strenge Bezug positiver Ergebnisse auf den Mund-/Kieferbereich ist dadurch zu erklären, dass nur dort septische Entzündungsherde lange Zeit relativ schmerzfrei als „stille Entzündung“ vom Patienten toleriert werden. Die Vermutung, dass der Kontakt zu Schwefelwasserstoffverbindungen im Darm die Ergebnisse beeinflussen kann, wurde durch Untersuchungen bei Patienten mit und ohne Dysbiose ausgeschlossen.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 309
Ganglioside sind wasserunlösliche Lipide und sind Bestandteil von Zellmembranen, insbesondere im zentralen und peripheren Nervensystem. Autoantikörper (AAk) gegen Ganglioside bewirken eine Entzündung oder Demyelinisierung der Markscheiden.
Sie rufen somit eine Vielzahl verschiedener Symptome hervor und gelten als typische serologische Marker für entzündliche autoimmune Neuropathien des peripheren Nervensystems. Dazuzählen das Guillain-Barré-Syndrom, das Miller-Fisher-Syndrom oder die chronisch-entzündliche demyelinisierende Polyneuropathie. Häufig treten entzündliche Neuropathien nach Infektionen, wie z. B. EBV, Campylobacter jejuni oder CMV auf.
Das liegt daran, dass gangliosidähnliche Strukturen auch an der Oberfläche von Mikroorganismen vorkommen und sich die entsprechenden Antikörper nicht nur gegen die Erreger richten, sondern auch gegen die Ganglioside der Markscheiden oder Nervenfasern. Die daraus resultierende Klinik reicht von leichter Ermüdbarkeit und uncharakteristischem Missempfinden über neuromuskuläre Störungen bis hin zu Funktionsausfällen wie Atemlähmung und Herzstillstand. Für die Differentialdiagnostik wird die Bestimmung der Gangliosid-Autoantikörper empfohlen. So können die autoimmunen Polyneuropathien (PNP) von anderen PNP abgegrenzt werden, wie z. B. die toxische PNP, die oft in Verbindung mit toxischer Enzephalopathie (TE) auftritt. Außerdem liefern sie auch gleich therapeutischrelevante Aussagen bezüglich des Subtyps der neuropathischen Störung.
Isoliert vorkommende Gangliosid-AAk können aufgrund der Kreuzreaktivität mit mikrobiellen Strukturen auch bei Gesunden nachweisbar sein. Die diagnostische Spezifität der Gangliosid-AAk steigt mit der Anzahl der positiv nachgewiesenen Antikörper.Daher wird im IMD immer das Antikörper-Profil mit 11 verschiedenen Gangliosiden untersucht (GM1, GM2, GM3, GM4, GD1a, GD1b, GD2, GD3, GT1a, GT1b, GQ1b).

Ein positives LTT-Ergebnis zeigt an, dass das T-zelluläre Immunsystem sich mit Candida auseinandersetzt.Das ist im Unterschied zu klassischen Infektionserregern wie Borrelien oder Chlamydien bis zu einem gewissen Grad normal, da eine Candidabesiedlung unserer Schleimhäute regelhaft gegeben ist.
Entscheidend ist aber die Höhe des Stimulationsindex (SI) im LTT. Ein hoher Wert im LTT auf Candida deutet auf eine gesteigerte Darmpermeabilität hin („leaky gut“), da bei reduzierter Darmbarrierefunktion auch bei „normaler“ Candidabesiedlung im Darm eine stärkere Konfrontation des Immunsystems mit Candida stattfindet (sekundäre Candidabelastung).
Diese Form tritt deutlich häufiger auf als eine primäre Candidabelastung (Infektion oder Nachweis pathologischer Mengen im Stuhl).Zur Differenzierung zwischen beiden Formen sollte der Zonulinspiegel im Serum als praktikabler und stabiler Marker für leaky gut herangezogen werden.Die Bestimmung von Zonulin im Stuhl kann nicht empfohlen werden.

Beim Lymphozytentransformationstest (LTT) werden Patientenzellen im Labor isoliert und anschließend mit den Borrelienantigenen stimuliert. Dieses erfordert funktionell intakte Immunzellen. Heparin ist im Gegensatz zu EDTA oder Citrat ein physiologisches Blutantikoagulanz. Es verhindert die Blutgerinnung nicht wie Citrat und EDTA, indem es den Immunzellen Calcium entzieht, sondern Heparin bindet an Antithrombin III, wodurch die Aktivität dieses körpereigenen Gerinnungshemmers 1000-fach verstärkt wird.Diese physiologische Gerinnungshemmung beeinträchtigt die Lymphozyten in der Phase zwischen Blutabnahme und Probeneingang im Labor nicht in ihrer Funktionalität.Das ist anders bei EDTA und Citrat, die den Lymphozyten das überlebenswichtige Calcium entziehen und damit viele Zellfunktionen blockieren. Das istder Grund, warum für alle immunologischen Funktionstests Heparinblut verwendet wird.Beim CD57-Test werden Natürliche Killerzellen lediglichquantifiziert. Es wird analysiert, welcher Anteil der NK-Zellen den Zellreifemarker CD57 auf der Oberfläche exprimiert. Hier ist es sogar erwünscht,dass sich der Wert nicht verändert (auf dem Transporti ns Labor). Daher ist bei allen quantitativen Zellphänotypisierungen (zelluläre Immunprofile etc.)das EDTA-antikoagulierte Blut immer das Standarduntersuchungsmaterial.

CD57 ist eine Glucuronyltransferase und Teil der Aktivierungskaskade der Natürlichen Killerzellen (NK). Die NK-Zellen, die das Molekül CD57 auf ihrer Zelloberfläche exprimieren, sind terminal differenzierte (ausgereifte) NK-Zellen. CD57-positive NK-Zellen (CD57+NK) zeigen im Vergleich zu den NK-Zellen, die CD57 nicht exprimieren (CD57-NK), die stärkere zytotoxische Kapazität. Im Normalfall exprimieren 30-60% der im Blut zirkulierenden NK-Zellen diesen Marker, wobei der Anteil im Alter ansteigt. Patienten mit chronischer Borreliose haben gehäuft eine verminderte Zahl an CD57+ NK-Zellen pro μl Blut. Diese Verminderung ist bei Patienten mit vorherrschenden neurologischen Symptomensignifikant deutlicher im Vergleich zu Patienten mit dominierenden muskulosketalen Beschwerden. Aus den Publikationen von Stricker et al. leitet sich die Empfehlung ab, den „CD57 Status“ als Verlaufsmarker bei chronischer Borreliose zu verwenden, da nach erfolgreicher Therapie und damit einhergehenden Symptomverbesserungen der Anteil anCD57+ NK-Zellen ansteigt bzw. bei persistierender Aktivität erniedrigt bleibt. Entscheidend ist hier der individuelle Verlauf beim einzelnen Patienten, nicht der einmalig gemessene Wert! Der CD57-Wert erlaubt dagegen nicht die Diagnosestellung„Borreliose“, da erniedrigte Werte auch bei anderen Infektionen (HIV, CMV, HSV2), Tumorerkrankungen, Immundefekten und in ca. 5% auch bei Gesunden zu beobachten sind.

Letzteres ist nicht unsere Empfehlung, sondern die seit 1. April 2014 gesetzlich bindende Vorgabe der Kassenärztlichen Bundesvereinigung. Wenn die Kosten über die GKV abgerechnet werden sollen,müssen auch wir uns daran halten. Der Hintergrund ist, dass man seitens der KBV meint, dass der ELISA ein hoch sensitiver Suchtest sei und der Blot diene nur als Bestätigungstest. Leider trifft das in Wirklichkeit nicht zu. Bei etwa 5 % der Immunoblots findet man IgG- oder IgM-Antikörper trotz negativem ELISA-Suchtest. Der Blot ist also sensitiver. Man muss akzeptieren, dass man ca. 5 % der Patienten falsch negativ testet, wenn man der Vorgabe folgt.
Für Privat-Versicherte und Selbstzahler-Patienten(IGeL) gilt diese Vorgabe nicht. Daher ist es sinnvoll,von Vornherein den sensitiveren und spezifischeren Immunoblot zu machen. Die früher verwendeten„line blots“ hatten den Nachteil, dass sie keine quantitativen Ergebnisse lieferten, sondern bei den einzelnen Banden im Laborbefund nur „positiv“oder „negativ“ angegeben wurde.
Der recomBead-Test liefert hingegen quantitative Resultate. Titer-Vergleiche zwischen zwei Zeitpunkten sind also möglich. Der recomBead-Test erfüllt zwar alle Kriterien eines Immunoblot (Spezifität,Sensitivität, Eignung als Bestätigungstest, Kosten), ist aber methodisch ein Multiplex-ELISA,weshalb damit die Titer der Antikörper gegen die einzelnen Borrelienbanden gemessen werden können.
Es ist also durchaus sinnvoll, von vornherein den recomBead-Test anzufordern, zumal diese Vorgehensweise sogar die Kosten in all den Fällen reduziert,in denen der ELISA positiv ausfällt. Es bleibt zu hoffen, dass sich auch die Vorgaben der GKV bald ändern.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 261
Der AGE-Blutspiegel ist von vielen Faktoren abhängig. Ein wichtiger Faktor ist dabei zum einen die Aufnahmemenge von Zucker, wobei beachtet werden muss, dass Fruktose und Galaktose sogar mehr AGEs induzieren als Glukose. Entscheidend ist aber auch, in welcher Form der jeweilige Zucker über die Nahrung zugeführt wird.
Weizen induziert z. B. einen raschen Blutglukoseanstieg und folglich mehr AGEs im Vergleich zu anderen Getreiden. Ursächlich dafür ist der schnelle enzymatische Abbau des im Weizen enthaltenen Amylopectins A durch die Amylase. Unabhängig vom Angebot an glykieren den Zuckermolekülen wird die endogene AGE-Bildung durch oxidativen Stress deutlich gefördert. Patienten mit oxidativem Stress (erkennbar an erhöhtem MDA-LDL) haben im Durchschnitt höhere AGE-Spiegel. Antioxidative Maßnahmen stellen deshalb neben der Diät eine wichtige Therapiesäule dar.
Ursache für unterschiedliche AGE-Spiegel sind auch individuelle genetische Konstellationen, die zu einer verstärkten endogenen Bildung, aber auch verändertem Abbau der AGEs führen. Vor allem deshalb kann die therapeutische Beeinflussung bei manchen Patienten schwieriger sein als bei anderen.
Die intestinale Resorption von präformierten AGEsaus der Nahrung (v. a. aus gerösteten, gegrillten und frittierten Lebensmitteln) ist abhängig von der Darmpermeabilität, weshalb das „Sündigen“ unterschiedliche Auswirkungen auf den AGE-Blutspiegel bei verschiedenen Patienten hat.
Das Erkennen und konsequente Behandeln erhöhter AGE-Spiegel ist deshalb sehr wichtig, weil erhöhte AGEs nicht nur die Gefäß- und Matrixalterung,sondern auch die Fehlfunktion zahlreicher Regulationsenzyme der antientzündlichen und antioxidativen Systeme fördern.
Zudem stellen AGEs wegen ihrer Affinität zur Bindung an den proentzündlichen RAGE-Rezeptor auf Makrophagen einen Entzündungstrigger dar. AGEs können sogar für sich alleine ursächlich für einen erhöhten TNF-α-Spiegel im Blut sein.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 306
Das HbA1c gehört in die Gruppe der Advanced Glycation End products (AGEs), hat aber hinsichtlich seines Anteils an den Gesamt-AGEs nur eine untergeordnete Bedeutung. Es wird als eine Art Biomarker für die langfristige Glukosebelastung bei Diabetikern empfohlen, da es speziell die Glykierung von Hämoglobin durch die Glukose aufzeigt. Das HbA1c erfasst allerdings keine glykierten Proteine und Nukleinsäuren sowie auch keine extern aufgenommenen AGEs z. B. aus gebratenem Fleisch, gebackenen Weizenprodukten oder aus Wurst.Im Gegensatz dazu erfasst der AGE-Serumspiegel sämtliche glykierte Proteine und Nukleinsäuren und zwar auch solche, die durch Fruktose und Galaktosemodifiziert (glykiert) wurden. Mittlerweile ist es unbestritten, dass Fruktose den Glykationsprozess sogar noch stärker induzieren kann als die Glukose und dass sowohl Lipidperoxidation wie auch Glukoseoxidation auf diesen Weg über die Dicarbonylderivate sogar den größeren Einfluss auf die AGE-Entstehung haben.Somit ist das HbA1c nach wie vor ein wichtiger Standardmarker,um beim Diabetiker indirekt Auskunft über den Blutglukosespiegel der letzten Wochen zuerhalten, während die AGEs eine weitergreifende Aussage ermöglichen. Sie sind ein Marker für die endogene und exogene Gesamtbelastung mit Glykationsprodukten und dementsprechend auch eher für die Diätüberwachung geeignet.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 306
Advanced Glycation Endproducts (AGEs) sind Proteine, Lipide und Nukleinsäuren, die durch Kohlenhydrate (Glukose, Fruktose) irreversibel verklebt sind (glykiert). Im Organismus hemmen sie Zell- und Enzymfunktionen, fördern die Zell- und Gewebealterung,wirken proentzündlich und prooxidativ.
Die im Blut messbaren AGEs setzen sich aus den endogen gebildeten und den mit der Nahrung aufgenommenen AGEs zusammen. Die endogene Bildung wird durch ein erhöhtes Angebot an Blutzuckerinitiiert. Die Lebensmittel, die den Blutzuckeram stärksten erhöhen, zeigen auch die stärkste AGE-Bildung (transiente Hyperglykämien).
Auch Getreide, und hier insbesondere der Weizen, ist als starker AGE-Bildner bekannt. Das Amylopectin Ades Weizens wird durch die Amylase am schnellsten"verdaut", was zu einem sehr schnellen Anstieg der Blutglukose führt. Unabhängig vom Angebot anglykierenden Zuckermolekülen wird die endogene AGE-Formation durch oxidativen Stress und chronische Entzündung deutlich gefördert.
AGEs können aber nicht nur endogen im Organismus entstehen, sondern auch schon fertig formiert über die Nahrung aufgenommen werden.Der AGE-Gehalt von Lebensmitteln ist sehr unterschiedlich.Fleisch, Wurst, Schinken, aber auch Käse enthalten viel AGEs. Vor allem Grillen, Braten und Frittieren sowie langes Kochen können den AGE-Gehalt um ein Vielfaches erhöhen. Allgemein sind die Lebensmittel AGE-reicher, die viele gesättigte Fettsäuren enthalten.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 306
Eine Weizenunverträglichkeit kann durch die Autoimmunerkrankung Zöliakie bedingt sein. Dabei wird durch das im Weizen vorkommende Gluten eine chronische Entzündung der Dünndarmschleimhaut hervorgerufen. Der Nachweis von Autoantikörpern gegen Transglutaminase und gegen Endomysium im Serum ermöglicht die Diagnostik einer aktiven Zöliakie. Bei unklaren serologischen Befunden, oder Patienten, die bereits eine glutenfreie Diät eingehalten haben, ist die Untersuchung auf die HLA-Merkmale DQ2, DQ7 und DQ8 wertvoll. Nur Träger mindestens eines dieser HLA-Merkmale können eine Zöliakie entwickeln, ein fehlender Nachweis dieser Merkmale schließt eine Zöliakie daher sicher aus.
Als weitere Ursache für eine Weizen-Unverträglichkeit kommen Allergien in Betracht.Die Sensibilisierung kann auf der Bildung vonIgE-Antikörpern (Typ I-Allergie) oder spezifischen Lymphozyten (Typ IV-Allergie) beruhen.Zum Ausschluss von Typ I-Allergien auf Weizen empfiehlt sich die Untersuchung auf allergenspezifisches IgE gegen Weizen (f4), Gliadin (f98)und Gluten (f79). Treten nach körperlicher Belastungund anschließendem Genuss von Weizenprodukten Symptome auf, sollte an die selten vorkommende „Weizenabhängige anstrengungsinduzierte Anaphylaxie (WDEIA)“ gedacht werden. Die Diagnostik erfolgt hier durch die Bestimmung des IgE gegen ω5-Gliadin (f416).
Bei Verdacht auf eine Typ IV-Sensibilisierung auf Weizen empfiehlt sich der LTT auf Weizen und Gluten.Sowohl den Weizen-Allergien als auch der Zöliakie liegen klare Pathomechanismen zugrunde,weshalb spezifische Laborparameter wie Autoantikörper, IgE-Antikörper oder der Nachweis spezifischer T-Zellen zur Verfügung stehen. Heute weiß man, dass Weizen aber auch das unspezifische Immunsystem aktivieren kann. Bei dieser sogenannten Weizensensitivität stehen bisher keine(Weizen)-spezifischen Messparameter zur Verfügung.Somit gilt nach derzeitigem Stand eine„Nicht-Zöliakie-Nicht-Weizenallergie - Weizensensitivität“als wahrscheinlich, wenn Weizen-Allergien und eine Zöliakie sicher ausgeschlossen sind, sowie wenn sich nach Weizen-Elimination die Symptome bessern und nach Weizenprovokation wieder auftreten.

Nein, das ist nicht egal. Das Zonulin im Blut bzw. Serum ist besser geeignet, wenn man beim Patienten "leaky gut" untersuchen möchte.Die bei Patienten mit chronisch entzündlichen Darmerkrankungen oder Reizdarm sowie gesunden Probanden erhobene Blut- und Stuhlergebnisse sind nicht identisch bzw. zeigten oft nicht einmal tendenziell eine direkte Beziehung zueinander.
Lediglich in einer Subgruppe von Patienten mit akut exazerbiertem Morbus Crohn konnten wir bei erhöhten Blutwerten auch gleichzeitig hohe Zonulinspiegel im Stuhl messen. Bei allen anderen Patienten mit gastrointestinalen Erkrankungen und Gesunden zeigte sich in unseren Vergleichsanalysen keine Korrelation.
Wie ist das zu erklären? Die wichtigste Ursache ist, dass das Zonulin, was im Stuhl messbar ist, vor allem aus dem Dickdarm herrührt. Das im Dünndarm in das Darmlumen abgegebene Eiweiß Zonulin wird durch intestinale und mikrobielle Proteasen noch während der Darmpassage abgebaut.
Im Blut wird Zonulin dagegen kaum degradiert. Der Blutwert erlaubt deshalb auch eine Aussage über höher liegende Darmabschnitte (Duodenum,Dünndarm). Die Zonulinwerte im Blut passen daherauch meist besser zu den aktuellen klinischen Beschwerden (Reizdarm, Schmerzen, Entzündung)und den messbaren Sekundärfolgen eines leaky gut(Mineralstoffmangel, Aufnahme toxischer Metalle),da der Dünndarm für die Verdauung und Resorption von Nährstoffen, aber auch toxischen Substanzen,wegen seiner größeren Fläche und der direkten Anbindung an das hepatische Pfortadersystem bedeutender als der Dickdarm ist.
Aus den genannten Gründen bietet das IMD die Zonulin-Bestimmung im Stuhl nicht mehr an, sondern nur noch im Blut (Serum).
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 275
Nein, da Antihistaminika als Histaminrezeptorenblocker lediglich die Wirkung des Histamins an deren Zielzellen blockieren, nicht aber die Aktivierung oder die Funktionalität der Mastzellen und basophilen Granulozyten. Im Falle einer vorliegenden Typ I Sensibilisierung lässt sich im Labor auch unter Antihistaminika die allergeninduzierte Histamin-aber auch Leukotrienfreisetzung problemlos bestimmen. Eine mögliche Einschränkung der Auswertbarkeit können dagegen Mastzellstabilisatoren (Cromoglicinsäure, Nedocromilnatrium) haben. Diese sollten wenn möglich 7 Tage vor der Blutentnahmeabgesetzt werden. Antihistaminika haben übrigens aus dem oben genannten Grund auch keinen Einfluss auf den Histaminspiegel im Blut, Mastzellstabilisatoren dagegen schon.
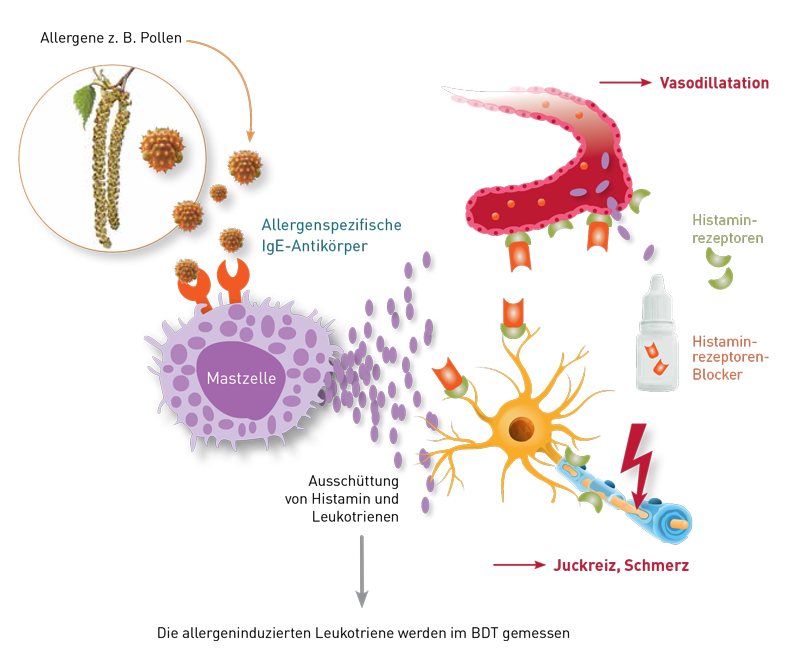
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 122
Er spielt in der Praxis keine wichtige Rolle. Methylhistamin im Sammelurin wird gern im Rahmen von Provokationstests gemessen, um den Anfall von Histamin im Organismus zu objektivieren. Bei aufwändigen und nicht ungefährlichen Provokationstests z. B. auf Medikamente oder Nahrungsmittel verlässt man sich ungern allein auf subjektive Angaben des Patienten.
Wo das Methylhistamin herkommt, ist aus der Graphik zu entnehmen. Es kommt nicht aus dem Abbau über die Diaminooxidase (DAO), sondern aus dem zweiten Abbauweg, nämlich der Histamin-N-Methyltransferase (HNMT, rechte Seite).
Da ca. 8 % der Bevölkerung einen HNMT-Mangel haben, könnte bei diesen der Parameter Methylhistamin im Urin im Rahmen von Provokationstests ohnehin unbrauchbar sein. Methylhistamin im Urin wird zudem manchmal an Stelle des Histamins im (Heparin)Blut empfohlen, z. B. bei Verdacht auf Mastzellaktivierungssyndrom oder auch Mastzell-assoziierter Entzündung. Das ist aber kritisch zu sehen. Der Parameter ist (ganz abgesehen von den o.g. 8 % mit HNMT-Mangel) zu wenig sensitiv für diese Fragestellung. Sogar bei Allergikern mit deutlichen Symptomen kommen erhöhte Werte selten vor.
Das liegt zum einen daran, dass die korrekte Präanalytik oft nicht eingehalten wird. Der Urin muss über 24 h, mindestens aber 12 h gesammelt werden, da Methylhistamin über die Niere nicht konstant ausgeschieden wird. Zum zweiten (gut erkennbar in der Graphik) wird Methylhistamin weiter zu N-Methyl-Imidazolessigsäure abgebaut und dieses weiter in zahlreiche andere Substanzen. Darum muss der Urin über Salzsäure gesammelt werden. Wenn das nicht ordnungsgemäß erfolgt, resultieren (falsch) normale Werte.
Insgesamt hat sich zum Nachweis der Mastzellassoziierten Entzündung (auch bei Mastzellaktivierungssyndrom) die Bestimmung von Histamin im Heparinblut als der sensitivste und sicherste Labormarker erwiesen. Bei Verdacht auf ein Mastzellaktivierungssyndrom sollten zusätzlich Tryptase, TGF-β, Serotonin und Leukotriene im Urin bestimmt werden, da Histamin nicht der einzige symptomauslösende Mastzellaktivierungsmarker ist.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Diese Empfehlung betrifft vor allem die sekundäre HIT. Diese ist definiert durch eine verminderte DAO-Aktivität trotz unauffälliger DAO-Genetik. Kupfer ist essentiell für die Funktion des histaminabbauenden Enzyms Diaminooxidase (DAO), da es als Zentralatom das aktive Zentrum des Enzyms stabilisiert. Somit kann ein Mangel an Kupfer die DAO-Aktivität herabsetzen (funktioneller DAO-Mangel) und verantwortlich für einen Histaminanstieg oder eine prolongierte Histaminwirkung sein.
Die Kontrolle der Kupferversorgung erfolgt über die Vollblutmineralanalyse (EDTA-Blut). Der Serumspiegel
ist nicht aussagekräftig, da bei Entzündungserkrankungen jeglicher Art durch Anstieg des Kupfertransportproteins Coeruloplasmin falsch erhöhte Werte trotz bestehendem Kupfermangels gemessen werden.
Wichtig: Im Unterschied zu einem genetisch bedingten DAO-Mangel ist ein funktioneller DAO-Mangel nur zu erfassen, wenn auch tatsächlich die DAO-Aktivität bestimmt wird. Leider wird in Folge der Kostenreduzierung von immer mehr Laboren nur noch die Mengenbestimmung der DAO mittels ELISA angeboten. Damit wird der funktionelle DAO-Mangel z. B. bedingt durch Kupfermangel, nicht erfasst.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Diese Frage haben wir vielfach gestellt bekommen. Der Grund ist eine weitreichende Verunsicherung, die dadurch bedingt ist, dass eine Reihe von Laboren in Deutschland einen seit 2014 verfügbaren, sehr einfach durchzuführenden DAO-ELISA-Test neu eingeführt haben.
Wir führen im IMD weiterhin den aufwändigeren DAO-Aktivitätstest (DAO-REA® der Firma Sciotec) durch.
Im Vergleich zur reinen Enzymmengenbestimmung mittels ELISA misst der DAO-Aktivitätstest die AKTIVITÄT der DAO anhand des Abbaus des Histaminanalogons Putrescin und erfasst deshalb nicht nur den genetisch bedingten DAO-Mengendefekt (primärer DAO-Mangel), sondern auch die gestörte DAO-Enzymfunktion (sekundärer DAO-Mangel).
Letztere ist für ca. 50 % der DAO-Funktionsverluste verantwortlich, so z. B. für alle sekundären Histaminintoleranzen durch Medikamentenblockaden, durch Kupfermangel oder Vitamin B6-Defizite. Mit dem DAO-ELISA-Test werden dagegen nur die primären (genetisch bedingten) Mangelzustände erfasst.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Beide Erkrankungen beruhen im wesentlichen auf einem Missverhältnis zwischen wirksamem Histamin im Organismus und dem Histaminabbau. Die Folge ist bei beiden Erkrankungen eine verstärkte Wirkung des Entzündungsmediators Histamin an den Histaminrezeptoren 1 bis 4. Symptome sind u. a. anfallsweise Fatigue, Flush, Diarrhoe, Übelkeit, Kopfschmerzen, Hitzegefühl und Asthma. Des Weiteren können aber auch Ekzeme, Rhinitis, Urtikaria, Hypertonie, Herzrhythmusstörungen und Colitis auftreten.
Von einer Histaminintoleranz (HIT) spricht man, wenn für die verstärkte und verlängerte Histaminwirkung der gestörte Histaminabbau verantwortlich ist. Die HIT sollte man nicht zu den Nahrungsmittelunverträglichkeiten zählen, weil auch endogen gebildetes Histamin (z. B. bei Typ I-Allergikern oder Parasitosen) zur Histaminbelastung des Organismus beiträgt. Im Gegensatz zur HIT liegt beim Mastzellaktivierungssyndrom (MAS) die verstärkte Freisetzung von Mastzellmediatoren daran, dass die Mastzellen eines Patienten zu leicht unspezifisch aktivierbar sind und schon bei geringen Reizen Histamin und andere Mastzellmediatoren freisetzen.
Die Labordiagnostik bei HIT erfolgt über die Bestimmung der Aktivität des histaminabbauenden Enzyms Diaminooxidase. Parallel wird Histamin im Heparin-Vollblut bestimmt. Bei Verdacht auf MAS ist die DAO meist normal oder sogar erhöht (weil das Enzym durch permanent erhöhtes Histamin induziert wird). Labordiagnostische Marker für das MAS sind neben dem erhöhten Histamin, erhöhte Werte für ECP, Tryptase oder TGF-β sowie für die Leukotriene C4, D4 und E4 im Urin.

Ja, im Rahmen des Immunmonitorings kann durch Messung von TGF-β im Serum in Kombination mit der Quantifizierung der regulatorischen T-Zellen (Treg) im Blut darauf geschlossen werden, ob durch die Therapie die Effektorzellantwort der T-Lymphozyten tatsächlich gestärkt wird (Abfall von TGF-β- und/oder der Treg-Zellen im Verlauf) oder ob der Therapieeffekt „stagniert“.
Im letztgenannten Fall d. h. bei Anstieg von TGF-β und der Zahl der Treg-Zellen ist eine Modifikation der immunstimulierenden Therapie anzuraten (Präparatewechsel). Die gute Aussagekraft von TGF-β leitet sich daraus ab, dass dieses Zytokin ein wichtiges Effektorzellzytokin der Treg-Zellen ist.
Im Gegensatz zu IL-10, (welches von Treg, TH2-Lymphozyten und Monozyten sezerniert wird) wird TGF-β von anderen Blutzellen allenfalls in sehr geringen Mengen freigesetzt.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 239, 276
Die Korrektur erfolgt nicht routinemäßig, kann aber auf Wunsch durchgeführt werden. Coenzym Q10 kann mit praktikablen Laborverfahren nur im Serum und nicht intrazellulär bestimmt werden. Üblicherweise findet sich aber eine gute Korrelation zwischen Q10 im Serum und den intrazellulären Spiegeln.
Coenzym Q10 bindet sich im Blut an Cholesterin. Deutlich erhöhte Cholesterinwerte können somit eine normale Coenzym Q10-Versorgung vortäuschen, da dann der Serum-Q10-Wert nicht zwingend mehr den intrazellulären Gehalt widerspiegelt. Deshalb wird von einigen Laboren die Korrektur an Hand des Cholesterinwertes als „unbedingt notwendig“ beworben. Wir empfehlen die Berichtigung dieses Phänomens auch, allerdings nur bei Cholesterinwerten über 350 mg/dl. Bei der zu Grunde liegenden Berechnungsformel kann erst bei Cholesterinwerten > 350 mg/dl oder höher ein grenzwertig normaler Coenzym Q10-Wert auch zu einem pathologischen Lipid-korrigierten Q10-Quotient von < 0,2 führen. Bei normalen Cholesterinspiegeln oder auch therapeutisch normalisierten Werten (z. B. unter Statintherapie) kann die Korrektur sogar fälschlich eine gute Q10-Versorgung vortäuschen. Dieses ist gerade deshalb fatal, weil die Gabe von Statinen nicht nur die Cholesterin-, sondern auch die Coenzym Q10-Synthese hemmt.
Sollten Sie die Lipid-Korrektur der Coenzym Q10-Werte ihrer Patienten auf dem Befund wünschen, vermerken Sie dieses bitte auf dem Anforderungsschein. Andernfalls haben Sie auf unserer Homepage auch die Möglichkeit, in Kenntnis des Coenzym Q10-Wertes die Lipidkorrektur selbst vorzunehmen, z. B. anhand der in Ihrem Hauslabor ermittelten Cholesterinwerte. Die entsprechenden Umrechnungsformeln und eine Umrechnungshilfe finden Sie hier.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 300
Für alle Einsendungen innerhalb von Berlin (d. h. bei denen wir die Proben innerhalb von 6 h im Labor verarbeiten)verwenden auch wir die Spezialröhrchen mit saurem Citrat als Antikoagulanz. Wenn das Blut aber länger als 6h zu uns unterwegs ist (d. h. immer wenn die Proben über Nacht per Kurier zu uns kommen), sind diese Spezialröhrchen keine Hilfe.Auch in diesem Blutröhrchen beginnt nach ca. 6h die Hämolyse von Erythozyten, weshalb es zum artifiziellen Anstieg von Homocystein kommt, welches aus Erythrozyten freigesetzt wird. Das bedeutet,dass Blutproben, die länger als 6h gelagert werden,unabhängig vom verwendeten Röhrchen in jedem Fall innerhalb weniger Stunden nach Blutabnahme zentrifugiert werden müssen und das Plasma/Serum in ein neues Röhrchen übernommen werden muss.Wenn das korrekt erfolgt, sind die Homocysteinwerte für beide Röhrchen identisch. Erfolgt die Zentrifugation aber nicht, messen wir am Folgetag aus beiden Röhrchen falsch hohe Werte.Um nicht erst den Eindruck zu vermitteln, dass man mit dem Spezialröhrchen vielleicht doch auch ohne Zentrifugation einigermaßen korrekte Werte erhält,verzichten wir bei Übernacht-Einsendungen zur Sicherung einer verlässlichen Präanalytik von vornherein auf diese Spezialröhrchen und führen die Analyse bei Übernachteinsendungen nur aus zentrifugiertem und korrekt vom Blutkuchen getrenntem Serum oder Plasma durch. Falsche niedrige Werte durch die Lagerung sind im übrigen nicht zu erwarten, da Homocystein sehr stabil ist.

Warum wird die Vollblutanalyse der Spurenelemente in Ihrem Labor ? nicht auf den Hämatokrit bezogen?
Die Vollblutmineralanalyse untersucht den Versorgungsstatus des Patienten mit essentiellen Spurenelementen. Diese Mineralstoffspiegel werden sinnvollerweise im Gesamt-Vollblut bestimmt, d. h. es werden die intra- und extrazellulären Spurenelemente erfasst. Eine "Normalisierung" auf den Hämatokrit findet dabei am IMD Berlin bewusst nicht automatisch statt, sondern nur auf besonderen Wunsch.
Strikt gegen die Hämatokritkorrektur spricht aus unserer Sicht die Gefahr, dass ein Mineralstoffmangel bei verminderten Erythrozytenzahlen im Blut (v. a. bei Anämie) unerkannt bleiben könnte. Außerdem sind viele Spurenelemente - wie z. B. Selen und Kupfer - intra- und extrazellulär lokalisiert und ihre Verteilung differiert von Patient zu Patient.
Die „Normalisierung“ der Werte anhand des Hämatokritwertes würde hier das Ergebnis verfälschen und einen Mangel möglicherweise „kaschieren“ (siehe Beispielbefund unten). Daher haben wir uns für die herkömmliche Angabe der Blutspiegel in μg/L bzw mg/L entschieden, wenn es um die Beurteilung des Versorgungsstatus mit Mineralstoffen geht.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 298
Bei der intrazellulären Analyse der Vitamine B1, -B2 und -B6 wird mittels HPLC die Stoffmenge der Vitamine bestimmt. Es ist dieselbe HPLC-Analyse wie bei der herkömmlichen Vitaminanalytik im Blut, nur dass hier vor der Analyse das Serum abgetrennt wird und nur der Blutkuchen in den Test eingeht. Somit werden die B-Vitaminspiegel in Erythrozyten und geringerem Umfang in Leukozyten bestimmt.
Bei der Analyse Vitamin B1, B2 und B6 Bioaktivität (ID-Vit®-Test) wird die Aktivität der Vitamine bestimmt. Dazu werden alle Zellen der Blutprobe lysiert und in eine Mikrotiterplatte gegeben, die mit vitaminsensitiven Mikroorganismen beschichtet sind. Das für jedes Vitamin individuell zusammengesetzte Medium enthält alle für ein Wachstum der Mikroorganismen notwendigen Bestandteile mit Ausnahme des jeweils zu messenden Vitamins. Nach Zugabe des Patientenblutes wachsen die Mikroorganismen solange, bis das Vitamin aufgebraucht ist. Die Menge an bioaktivem Vitamin des Patienten ist dabei direkt proportional zum Wachstum der Mikroorganismen.
Die Indikationsstellung einer Vitamin-Substitution und die Erfolgskontrolle sollte sich an der Bioaktivität ausrichten und nicht am Substanzspiegel. Der Vorteil der Aktivitätsmessung überwiegt gegenüber dem Fakt, dass hier neben dem zellulären (v. a. erythrozytären) Anteil auch der geringe Gehalt des Serums eingeht.
Der einzige tatsächliche Nachteil der Bioaktivitätsanalyse ist, dass der ID-Vit®-Test aufgrund seiner höheren Kosten keine GKV-Kassenleistung ist und als IGeL-Leistung abgerechnet wird (Kosten 33,22 € je Vitamin). Für Privatpatienten sind die Kosten pro Vitamin aber immer identisch, da die Abrechnungsziffern nicht zwischen Serum, intrazellulärer oder Bioaktivitätsmessung unterscheiden.

Wir führen die Vitaminbestimmung mit der Bioaktivitätsmethode bei den Vitaminen B1, -B2, -B6 und –B12 sowie bei der Folsäure durch.
Es ist allgemein sinnvoll bei Vitaminen, wo die Vitaminzufuhr einschließlich der therapeutischen Substitution mit Prä-Vitaminen (pro drugs) erfolgt, die von körpereigenen Enzymen erst noch aktiviert werden müssen.
Es betrifft aber auch die Vitamine, die im Blut als unterschiedliche vitaminwirksame Derivate vorliegen. Zum Beispiel stellt Vitamin B6 einen Mix aus 6 interkonvertiblen Substanzen dar, namentlich Pyridoxal (PL), 1-Pyridoxin (PN), Pyridoxamin (PM), Pyridoxal-5-phosphat (PLP), 1-Pyridoxin-5-Phosphat (PNP) und Pyridoxamin-5-Phosphat (PMP) sowie das Endprodukt des Vitamin-B-Metabolismus 4-Pyridoxalsäure. Allgemein anerkannt ist, dass Pyridoxal-5-phosphat der wirksamste Bestandteil ist, wobei für den Vitamineffekt aber auch die Verhältnisse der einzelnen Metabolite entscheidend sind.
Insgesamt empfehlen wir, wenn es um die „Versorgungssituation“ bei Patienten mit chronischen Entzündungen geht, den Bioaktivitätstest zu wählen und sich bei der Substitution hinsichtlich Dosis und Präparateauswahl an den Aktivitätswerten zu orientieren.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 307
Grundsätzlich ist die Analyse sowohl aus Spontanurin, 24-Stunden-Sammelurin als auch aus Serum und EDTA-Blut gleichermaßen möglich. Es bestehen jedoch Unterschiede in der Aussagekraft zwischen den Materialien:
• Wir empfehlen zur Messung der aktuellen Jodversorgung die Analyse von Spontanurin oder 24-Stunden-Urin. Aufgrund der simplen Probengewinnung wird in der Praxis häufig Spontanurin bevorzugt. Dennoch liefert die Analyse von 24-Stunden-Urin ein exakteres Ergebnis, weil Schwankungen im Tagesverlauf ausgeglichen werden.
• Die Serumanalyse hingegen zeigt die Menge an im Blutkreislauf zirkulierendem Jod an. In den Messwert fließt auch das an Schilddrüsenhormone gebundene Jod ein. Der Serumspiegel wird daher durch Veränderungen des Schilddrüsenstoffwechsels mit beeinflusst. Anders als bei Mineralstoffen bietet die Messung von Jod im EDTA-Vollblut keinen Vorteil gegenüber der Serumanalyse. Im EDTA- wie im Heparin Vollblut sind regelmäßig niedrigere Spiegel zu finden.
Darüber hinaus ist die Jodbestimmung im Rahmen des „Jodsättigungstests nach Dr. Abraham“ möglich. Hier wird die Sättigung von Organen/Gewebe mit Jod untersucht. Nach Gabe einer hohen Dosis
Jod wird die Ausscheidung im 24-Stunden-Urin gemessen. Nach Dr. Abraham ist eine Jodsättigung des Gewebes erreicht, wenn mindestens 90 % der Zufuhr wieder ausgeschieden werden. Die bei diesem Test verabreichte Dosis überschreitet i. d. R. bei weitem die Menge, die schulmedizinisch als sichere Tagesdosis angesehen wird. Ob der Jodsättigungstest bei einem Patienten durchgeführt werden soll, erfordert daher eine sorgfältige klinische Evaluation durch den behandelnden Arzt.

Die getrennte Bestimmung in Monozyten und Lymphozyten erlaubt eine Aussage darüber, ob ein Glutathionmangel durch verstärkten Verbrauch bedingt ist oder durch einen Mangel an „Rohstoffen“ für die Gluathionssynthese, insbesondere Cystein.
Monozyten zirkulieren nach Übergang aus dem Knochenmark nur 24 h im Blut, gehen dann ins Gewebe und kommen nicht zurück ins Blut. Ein niedriges GSH in Monozyten zeugt somit von einem primären Mangel an Cystein oder (selten) einem GSH-Synthesedefekt.
Lymphozyten rezirkulieren zwischen Gewebe und Blut. Insofern spiegelt das GSH in Lymphozyten eher den „Verbrauch“ im Gewebe wieder bzw. die reduzierte Regeneration.
In der Praxis zeigt also ein vermindertes GSH in Lymphozyten bei normalem Monozytenwert, dass das GSH sekundär aufgrund einer Immunaktivierung oder verstärkten prooxidativen Belastung reduziert ist. In diesem Fall wäre eine Glutathion- oder ACC-Substitution allein wenig erfolgversprechend, sondern sie sollte von einer antientzündlichen und/oder antioxidativen Therapie begleitet sein.
Die zusätzliche Bestimmung in NK-Zellen begründet sich durch die essentielle Rolle der NK-Zellen im Rahmen der Tumorimmunität. Heparinblut wird von uns dem EDTA-Blut vorgezogen, weil Heparin ein physiologisches Antikoagulanz ist. EDTA entzieht als Chelatbildner dagegen den Zellen Calcium (und andere Spurenelemente). Ein Calciummangel während des Bluttransportes ins Labor kann für einen artifiziellen GSH-Mangel und somit falsch niedrige Werte verantwortlich sein.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 163
Malondialdehyd (MDA) ist das Endprodukt des oxidativen Fettsäureabbaus (Lipidperoxidation). Die Bestimmung von MDA im Urin oder Blut ist allerdings nicht praktikabel, da die biologischen zeitlichen Schwankungen groß sind und wegen der geringen Stabilität ein Transport der Patientenprobe ins Laborin gefrorenem Zustand erfolgen müsste. In der Praxis hat sich aufgrund der unkomplizierten Präanalytik und der geringen biologischen Schwankungen das Malondialdehyd-modifizierte LDL (MDA-LDL) etabliert. Dabei handelt es sichum das Blutfettmolekül LDL, welches in Folge des „Einwirkens“ von Malondialdehyd oxidiert wird. MDA-LDL ist somit ein stabiler und verlässlicher Biomarker des oxidativen Stress. Ähnlich wie z. B. in der Diabetologie das HbA1c als Biomarker der Blutglukosepräsenz über einen Zeitraum von meheren Wochen dient, trifft man mit dem MDA-LDL eine Aussage über den im Organismus durchschnittlich über diesen Zeitraum aufgetretenen oxidativen Stress.
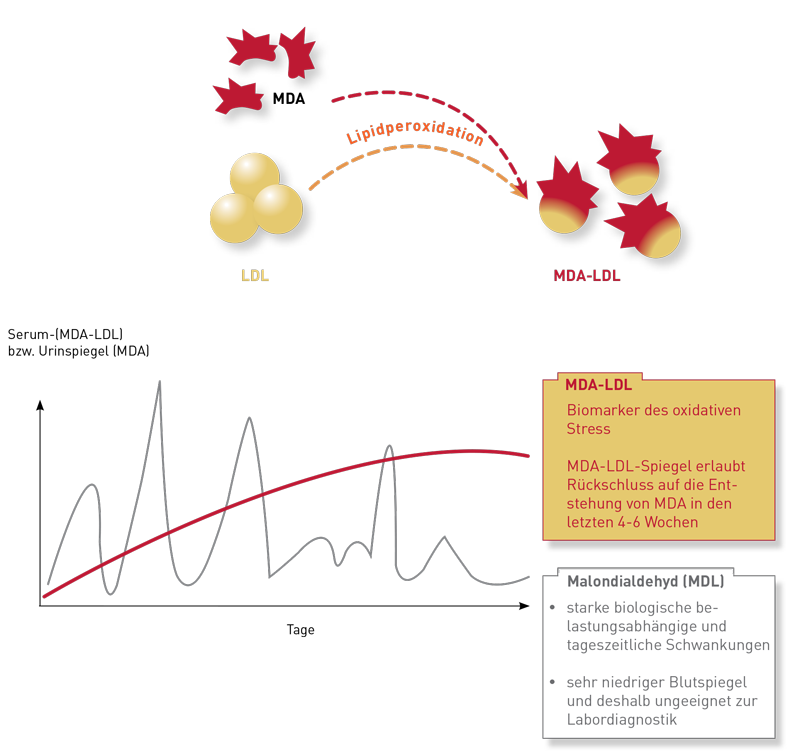
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 259
Unter oxidativem Stress versteht man ein gestörtes Gleichgewicht zwischen der Bildung freier Sauerstoffradikale (reactive oxygen species, ROS) und deren Abbau (Neutralisation) durch verschiedene Schutzsubstanzen wie zum Beispiel Antioxidantien. Freie Sauerstoffradikale entstehen nicht nur beim lebensnotwendigen Atmungs- und Verbrennungsprozess, sondern sie werden auch durch äußere Einflüsse wie Rauchen, UV-Licht, Ozon, Umweltschadstoffe und Medikamente induziert.
Neben den freien Sauerstoffradikalen können unter oxidierenden Bedingungen auch Stickstoffmonoxid- Radikale (NO*) entstehen, von denen sich das sehr reaktive Peroxinitrit ableitet. „Spender“ des Stickstoffes (N) ist vor allem die Aminosäure Arginin. Man spricht dann von „nitrosativem Stress“. Da das hoch reaktive Peroxynitrit die Aminosäure Tyrosin zu Nitrotyrosin nitriliert, dient Nitrotyrosin als Biomarker des nitrosativen Stress.
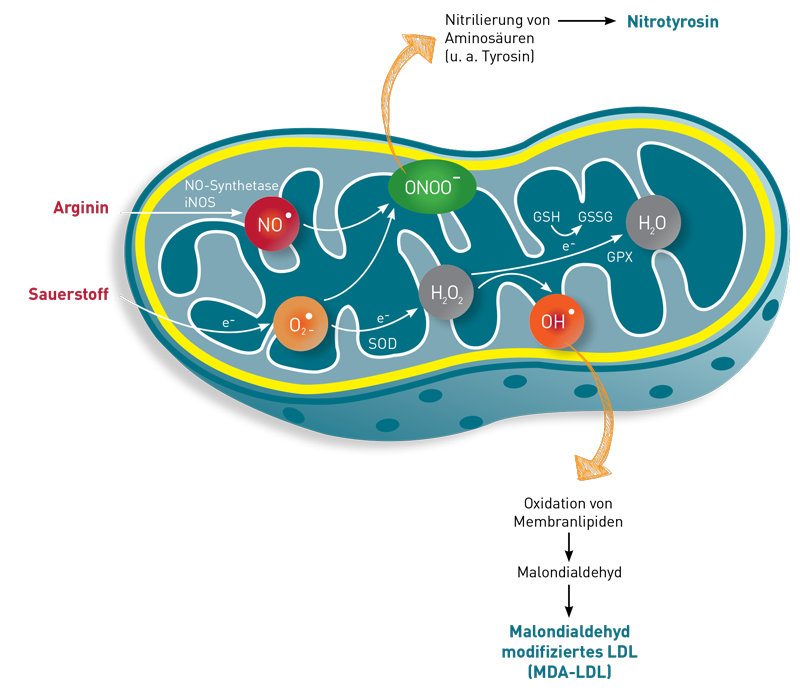
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 138
Die Analyse ATP-intrazellulär macht eine Aussage über die tatsächliche Funktion der Mitochondrien zum Zeitpunkt der Blutabnahme. Diese wird beeinflusst durch Entzündungsmediatoren, durch oxidative oder nitrosative Belastung (z. B. Peroxynitrit) sowie durch die Genetik, die Versorgung mit Spurenelementen, NADH, Coenzym Q10 u. a. Der ATPBelastungstest untersucht hingegen die Widerstandsfähigkeit der Mitochondrien im Fall einer Belastung. Diese Frage ist zwar interessant, labordiagnostisch aber kaum zu realisieren. Reproduzierbare Werte können nur innerhalb von zwei Stunden nach Blutentnahme gemessen werden, danach überwiegen präanalytisch bedingte Artefakte.
Wie die Abbildung zeigt, wäre hier auch nicht zu unterscheiden, ob das Agens direkt auf die Mitochondrien wirkt oder über die Aktivierung von NFκB. Zusätzlich stellt sich die Frage, womit eine „Belastung“ im Labortest adäquat imitiert werden kann. Der zelluläre Stress einer chronischen Entzündung oder einer multiplen Schadstoffbelastung ist sehr komplex und lässt sich nicht durch einzelne Komponenten wie z. B. das häufig genutzte Thiomersal nachahmen. Thiomersal (Ethylquecksilber) als Hemmsubstanz wurde aus der Studie von Sarah Myhill mit CFS-Patienten (Int J Clin Exp Med. 2009) übernommen, wo es aber nur Modellcharakter hatte. Unwahrscheinlich ist auch, dass die Resistenz der Mitochondrien bei jeder Art von „Belastung“ durch dieselben Schutzmechanismen aufrecht erhalten wird. Um den tatsächlichen Reiz der chronischen Entzündung nachzuvollziehen, wäre es praxisrelevanter, TNF-α und IL-1 (oder einen ganzen Cocktail von Entzündungsmediatoren) als Hemmittel einzusetzen oder aber Peroxidradikale. Hier sind aber noch aufwändige Studien nötig, um mit einem präanalytisch machbaren Labortest therapierelevante Ergebnisse zu erhalten.
Bei der Betreuung von Leistungssportlern hat es sich bewährt, dass ATP-intrazellulär vor und nach z. B. Ergometerbelastung zu messen. Das erfordert zwar zwei Blutabnahmen, erfasst aber eine tatsächlich relevante Belastung. Möglicherweise lässt sich das zukünftig zur Beurteilung der mitochondrialen Stressresistenz so oder ähnlich auch für andere Patientengruppen anwenden, was aber Standards erfordern wird.

Mit Hemmtesten lässt sich die in vitro-Wirksamkeit von Immunmodulatoren auf die Freisetzung von bestimmten Entzündungszytokinen erfassen. Gut etabliert ist der TNF-α-Hemmtest, weil TNF-α am Beginn der Entzündungskaskade von Monozyten steht.
Daher lässt sich anhand des modulierten TNF-α-Spiegels unmittelbar auf die NFκB-Aktivierung der Monozyten schließen. Auch der Hemmtest für das TH2-Zytokin IL-4 ist aussagefähig, weil TH2-Lymphozyten im Blut permanent rezirkulieren.
IL-33 dagegen ist zwar in der Tat ein interessantes proentzündliches Zytokin, es eignet sich aber nicht für in vitro Hemmteste. Der Grund ist, dass IL-33 nicht oder kaum von Blutzellen sezerniert wird, sondern von Fibroblasten der Haut, Epithel- und Endothelzellen, Astrozyten im ZNS und in geringem Ausmaß auch von Promonozyten des Knochenmarkes.
Die in einer dem Patienten entnommenen Blutprobe vorhandenen Monozyten und T-Lymphozyten sezernieren IL-33 gar nicht oder nur in geringstem Ausmaß. T-Lymphozyten sind lediglich die Zielzellen von IL-33, wo es die TH2-Prägung verstärkt.
Insofern kommen wir für die Labortestung an die Zellen, die IL-33 tatsächlich sezernieren, gar nicht heran, weshalb Hemmteste, die mit peripherem Blut durchgeführt werden, für IL-33 nicht aussagefähig sind. Gleiches gilt für viele andere Zytokine.

Das geht nur bedingt. Präparate wie Acetylsalicylsäure, Ibuprofen, Naproxen, Diclofenac, Indometacin, Piroxicam oder Phenylbutazon wie auch die selektiven Cox-2-Hemmer Celexocib hemmen das Enzym Cyclooxygenase (COX). Damit vermindern diese Präparate die Synthese von schmerz- und entzündungsauslösenden Prostaglandinen und Thromboxanen aus der Arachidonsäure. Der TNF-α-Hemmtest erfasst aber nicht die Prostaglandinsynthese (und somit auch nicht deren Hemmung durch Therapeutika), sondern die durch NFκB in Monozyten und Makrophagen initiierte myelomonozytäre Entzündungsreaktion. Diese läuft über TNF-α, IL-1 und IL-6. Auch die Wirksamkeit von Präparaten, welche die Lipoxygenase hemmen (LOX-Hemmer), werden im TNF-α-Hemmtest nicht erfasst.
Manchmal werden allerdings die Cyclooxygenasehemmer im TNF-α-Hemmtest bewusst mit untersucht, weil es Patienten gibt, bei denen sie die NFκB-induzierte Entzündung sogar fördern. Dieses kann in seltenen Fällen ein Therapieversagen erklären, sogar dann, wenn (was im TNF-Hemmtest aber nicht erkennbar ist) die Prostaglandinsynthese effektiv unterdrückt wird. Insofern ist also ein fehlender TNF-α-hemmender Effekt bei den NSAR und selektiven COX-2- oder LOX-Hemmern tolerabel und spricht nicht gegen die weitere Verabreichung. Bei einem TNF-α-stimulierenden Effekt sollte die Gabe allerdings kritisch überdacht werden,wenn der klinische Erfolg ausbleibt.
Interessanterweise kommt es bei einigen Patienten aber sogar zur TNF-α-Hemmung, was daraufhin deutet, dass es direkt oder indirekt (über Prostaglandineffekte auf Monozyten) doch zu einer NFκB-Hemmung durch NSAR oder COX-2-Hemmern kommen kann.

Nein. Diese Präparate bewirken ihren antientzündlichen Effekt nicht über die Hemmung der NFκB-Aktivierung in den Entzündungszellen, sondern sie vermindern die Entzündungssymptome,indem sie die Wirkung von TNF-α an den Zielzellen blockieren. Deshalb werden sie auch als TNF-α-Blocker bezeichnet.
Etanercept (u. a. Enbrel®) ist ein gentechnisch hergestelltes Fusionsprotein, welches zirkulierendes TNF-α bindet. Es fungiert somit als löslicherTNF-Rezeptor. Das von Etanercept gebundene TNF-α kann dann nicht mehr an seinen natürlichen, an der Zellmembran befindlichen Rezeptorbinden und somit keine Entzündungsprozesse im Organismus auslösen.
Ein anderes Wirkungsprinzip verfolgen die monoklonalen TNF-Antikörper Adalimumab (z. B. Humira®) und Infliximab (z. B. Remicade®). Diese Antikörper binden ebenfalls an TNF-α, allerdings nicht wie ein Schlüssel, der genau auf das Schloss passt, sondern als ein Anhängsel am TNF-Molekül. Durch die Bindung des Antikörpers an TNF-α verändert sich die Form des Zytokins mit der Folge, dass es nicht mehr in den zellständigen Rezeptor am Zielorgan passt. Der Effekt ist letztlich der gleiche. Die Auslösung oder Verstärkung der entzündlichen Reaktion durch TNF-α an den Organen wird gehemmt.
Mit dem TNF-α-Hemmtest lassen sich nur Präparate untersuchen, deren Wirkmechanismus es ist, die Aktivierung der NKκB-assoziierten Entzündungskaskarde,messbar von der Sekretion von TNF-α zu reduzieren. Dazu gehören neben Kortison auch viele Phytotherapeutika wie Curcumin, Boswellia-Präparate, Brennessel, Antioxidantien und viele weitere, oft wegen ihrer als antientzündlich bekannten Wirkung genutzten, Präparate.

Ja. TNF-α dient im Labortest nur als Markerzytokin für die Aktivierung der Monozyten und Makrophagen. Der Test misst anhand der Freisetzung des TNF-α, ob das jeweilige Präparat einen Einfluss auf die NF?B-assoziierte Entzündungskaskade hat. Die Aussage hinsichtlich der Präparatewirkung ist somit auf IL-1 oder IL-6 übertragbar. Im Vergleich zu diesen Mediatoren hat sich TNF-α als besser und sensitiver herausgestellt, was daran liegt, dass TNF-α das erste Zytokin der Kaskade darstellt und damit der geringsten posttranslationalen Modulation unterliegt. Insofern ist der TNF-α-Hemmtest bei jeder Art einer myelomonozytären Entzündung hilfreich, auch wenn diese durch ein erhöhtes CRP, IL-1 oder IL-6 nachgewiesen wurde. Der TNF-α Hemmtest ist ein globaler Entzündungshemmtest.
Keine Aussage macht der Test, ob ein Präparat antientzündlich direkt auf Lymphozyten oder Mastzellen wirkt.

Ja, man kann untersuchen, welchen Einfluss therapeutische Substanzen in vitro auf Immunzellen von
Patienten haben. Diese Vortestung mit dem TNF-α-Hemmtest ist dann sinnvoll, wenn man für eine adjuvante, antientzündliche Therapie das individuell wirksamste Präparat vor Therapiebeginn selektieren möchte.
Beim TNF-α-Hemmtest wird dem Patienten Blut abgenommen und im Labor mit Zellkulturmedium verdünnt. Anschließend wird durch Zugabe von aus bakteriellen Zellwänden gewonnenem Lipopolysaccharid (LPS) in der Zellkultur eine Entzündung induziert (Aktivierung der NFκB-assoziierten Entzündungskaskade). Diese LPS-induzierte TNF-α-Freisetzung stellt den Basiswert dar. In parallelen LPS-induzierten Ansätzen wird untersucht, welchen Einfluss zusätzlich applizierte, antientzündliche Präparate auf die NFκB-Aktivierung und die damit einhergehende Entzündung haben. Wird durch die Gabe eines Präparates der LPS-induzierte TNF-Wert niedriger als der Basiswert ohne Präparat, weist das einen antientzündlichen Effekt nach. Ist der TNF-Wert hingegen höher im Ansatz mit dem Präparat als im Ansatz ohne Präparatzugabe, dann hat das Präparat eine proentzündliche Wirkung und sollte nicht verordnet werden.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 246
Das geht meist nur bei frischen (akuten) Infektionen,nicht aber bei den häufiger zur Frage stehenden chronischen Infektionen. Bei akuten bakteriellen systemischen Infekten steigt neben CRP auch der Tumor-Nekrose-Faktor-alpha (TNF-α)und das Interleukin-6 an. Anstiege von PCT und LBP sind nur bei schweren systemischen (meist stationär behandlungsbedürftigen) Infektionen zu beobachten.In der ambulanten Versorgung sind sie entbehrlich.
Viren induzieren dagegen eine Aktivierung von TH1-Effektorlymphozyten. Das geht mit einem Anstieg von Interferon-gamma (IFN-γ) einher. Das IFN-γ ist im Blut über den Biomarker IP-10 zu erfassen. Zytokine wie Interleukin-2 und Interleukin-12 sind im Serum kaum messbar. Ihre Bestimmung ist unnötig. Ein sensitiver Nachweis der Lymphozytenaktivierung ist über die Bestimmung aktivierter T-Lymphozyten im zellulären Immunprofil möglich.
Differenzierung zwischen bakteriellen und viralen Infektionen ist in der chronifizierten Phase über Serumzytokine nur eingeschränkt möglich, weil oft sowohl TNF-α als auch IP-10 erhöht sind. Dieses widerspiegelt den komplexen Pathomechanismus der systemischen Inflammation, wo sich Zellen untereinander aktivieren.
Erschwerend kommt hinzu, dass die Immunabwehr gegen intrazellulär persistierende Bakterien (z. B. Borrelien, Chlamydien, Mycoplasmen, Mykobakterien)eher der Immunantwort gegen Viren als der von Bakterien entspricht, da diese Immunantwort durch T-Lymphozyten getragen wird. Unsere eigenen Untersuchungen haben aber gezeigt, dass bei aktiven (chronischen) Borreliosen und Chlamydieninfekten die Zytokine im Serum häufig nicht ansteigen, d. h. normale Serumzytokine eine aktive(chronische) Infektion mit diesen Erregern nicht ausschließen.

Streng genommen macht nicht nur die Immunaktivierung den Zustand der chronischen Entzündung aus, sondern auch der damit assoziierte oxidative und nitrosative Stress sowie die sekundäre Mitochondriopathie. Daher werden zumeist auch MDA-LDL, Nitrotyrosin und das in Leukozyten gemessene intrazelluläre ATP in das Profil „Chronische Entzündung“aufgenommen. Im IMD hat sich für dieses 6-Analyten-Profil die Bezeichnung „Profil Multisystemerkrankung“durchgesetzt.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 279
Nein, weil bisher alle Versuche fehlgeschlagen sind, für diese Erreger analog zum LTT auf Borrelien, Chlamydien oder Yersinien eine verlässliche LTT-Methodik zu entwickeln.
Das Problem ist die Spezifität. Mit allen kommerziell verfügbaren und bisher von uns untersuchten Testantigenen der vier genannten Bakterien waren viel zu viele gesunde Testprobanden falsch positiv.
Des Weiteren besteht die Schwierigkeit darin, dass zur T-Zellimmunologie dieser Erreger kaum etwas bekannt und publiziert ist. Der Stand der Forschung zu diesen Erregern ist geradezu verschwindend gering im Vergleich zu Borrelien oder Chlamydien. Deshalb ist es leider so, dass nur die Serologie als diagnostische Methode für Babesien, Ehrlichien, Bartonellen und Rickettsien zur Verfügung steht. Dies ist aber bei chronischen Infektionen wenig hilfreich, weil sie nicht zwischen einer aktiven chronischen Infektion und einem Kontakt in der Vergangenheit unterscheiden kann.
Etabliert ist die Serologie auf diese Erreger nur zum Nachweis einer frischen Infektion. Mit Ausnahme von Bartonellen wird nur auf IgG und IgM untersucht. Da IgM bei chronischen Infektionen regelhaft negativ ist, kann sie an Hand des IgGs lediglich einen stattgefundenen Kontakt anzeigen, wobei auch hier die Sensitivität und Spezifität unbefriedigend sind. Lediglich bei den Bartonellen, wo IgG in ca. 35 % der Patienten positiv ist, zeigt sie an, bei welchen Patienten eine aktive Infektion zumindest zu erwägen ist. Am IMD wird deshalb intensiv an adäquaten Alternativen gearbeitet. Das VEGF ist für die Bartonellen ein erster Lichtblick, denn hohe Werte sprechen für eine aktive Infektion.
Die Strategie des intrazellulären Überlebens von Bartonellen

Unser Organismus verfügt über drei Entzündungssysteme, die von den unterschiedlichen Auslösern (Triggerfaktoren) differenziert aktiviert werden. So aktivieren Viren, intrazelluläre Bakterien, Tumorantigene oder auch Metalle eher die TH1-Lymphozyten (lymphozytäre Entzündung). Das unspezifische myelomonozytäre Immunsystem mit den Monozyten,Granulozyten und Makrophagen wird durch extrazelluläre Bakterien, Immunkomplexe oder auch Partikel (einschließlich Titanoxid) aktiviert.
Die Aktivierung von Mastzellen und damit die Induktion der mastzellassoziierten Entzündung erfolgt durch Allergene, aber auch durch Bakterien und zahlreiche Umweltschadstoffe. Daraus leitet sich ab, dass wir mindestens drei Entzündungsmarker messen müssen, um alle drei Entzündungssysteme sicher zu erfassen. Das sind für die myelomonozytäre Entzündung das TNF-α, für die Lymphozyten das IFN-γ (welches allerdings über seinen Biomarker IP-10 im Blut analysiert wird) sowie für Mastzellen das Histamin (im Vollblut).

Ein verminderter ATP-Wert zeigt eine Stoffwechselstörung in den Mitochondrien an, weshalb das ATP-intrazellulär (gemessen in Leukozyten, die aus dem Blut des Patienten isoliert werden) ein wichtiger und direkter Marker für die sekundäre Mitochondriopathie ist. Für die Messung des ATP wird ausschließlich Heparinblut verwendet, da andere gängige Antikoagulantien wie Citrat oder EDTA durch ihre Kalziumblockade zahlreiche Zellstoffwechselprozesse „künstlich“ hemmen. Das Heparinblut darf zwischen Blutabnahme und Laboranalyse keinen signifikanten Temperaturschwankungen ausgesetzt sein und muss zügig (ca. 24 h), d. h. per Kurier ins Analyselabor gelangen.
Ein weiterer, (indirekter) Marker für die sekundäreMitochondriopathie ist ein Anstieg der Laktat /Pyruvat-Ratio. Bei gestörter Mitochondrienfunktion wird Pyruvat nicht ausreichend in Acetyl-CoA umgewandelt, sondern vermehrt zu Laktat reduziert. Bei der Bestimmung von Laktat und Pyruvat ist darauf zu achten, dass beide Metaboliten in Natriumfluorid (NaF)-antikoaguliertem Blut bestimmt werden, da NaF die Glykolyse auf dem Transport in das Labor hemmt.
Nicht geeignet als Marker für die Mitochondriopathie sind die LDH-Isoenzyme und die M2PK. Die LDH-Isoenzyme haben nur dann eine Aussage, wenn die Blutprobe unmittelbar nach Blutabnahme hochtourig zentrifugiert wird, da ansonsten eine eintretende Hämolyse der Erythrozyten zu falsch erhöhten Werten für die LDH4 und LDH5 führt. Unsere Erfahrung ist, dass nach der Zentrifugation mit den üblicherweise in Praxen vorhandenen Zentrifugen noch zu viele Erythrozyten im Überstand sind.
Die M2PK ist eine Isoform der Pyruvatkinase, die in einigen Tumorzellen über exprimiert wird. Deshalb hat die M2PK im Stuhl eine gewisse Bedeutung in der Darmkrebsdiagnostik erlangt. Allerdings wird die M2PK in allen schnell proliferierenden Zellen auch ohne tumoröse Entartung exprimiert, z. B. bei lokalen aber auch systemischen Entzündungen;weshalb sie als diagnosticher Marker zur Tumorsuche eine relativ geringe Spezifität besitzt.Das erklärt auch, warum M2PK im EDTA-Blut sehr häufig bei Patienten mit Entzündungserkrankungen ansteigt und letztlich eher zu Verunsicherungen führt.

Die am häufigsten angewandte Methode für den Nachweis des Vitaminenspiegels ist die Mengenbestimmung mittels chromatographischer Analyseverfahren (u. a. HPLC). Dieses kann im Serum, EDTA-Plasma oder auch intrazellulär erfolgen (im Blutkuchen nach Abtrennung flüssiger Blutbestandteile). Dieses quantitative Verfahren differenziert jedoch nicht zwischen aktiven und inaktiven Vitaminmetaboliten. Die Blutproben für die Bestimmung der Vitaminaktivität (ID-Vit®) werden enzymatisch vorbehandelt und verdünnt in eine Mikrotiterplatte gegeben, die je nach Vitamin mit vitaminsensitiven Lactobacillus fermentum, Lactobacillus rhamnosus bzw. Saccharomyces cerevisiae beschichtet sind. Das für jedes Vitamin individuell zusammengesetzte Medium enthält alle für ein Bakterien-/ Hefewachstum notwendigen Bestandteile mit Ausnahme des jeweils zu messenden Vitamins. Nach Zugabe des Patientenblutes wächst die Bakterienkultur, bis das (aktive) Vitamin aufgebraucht ist. Das Wachstum der Bakterien wird nach 72 h als Trübung im Photometer gemessen und mit einer Standard-Konzentrationsreihe verglichen. Die Menge an bioaktivem Vitamin im zugegebenen Patientenblut ist dabei direkt proportional zum Bakterien-/ Hefewachstum.

Die Prävalenz chronisch verlaufender Entzündungserkrankungen nimmt in allen industrialisierten Ländern zu. Zu diesen Erkrankungen zählen Allergien, rheumatische Erkrankungen, Magen-, Darm- oder Schilddrüsenkrankheiten, Herz-Kreislauferkrankungen sowie die Parodontitis und andere chronische Infektionen. Die Fortschritte der Hochleistungsmedizin haben die Komplikationen der Erkrankungen gemindert, nicht aber deren Häufigkeit.
Warum werden chronisch entzündliche Erkrankungenhäufiger?
Im Gegensatz zur akuten Entzündung, die eine notwendige Reaktion unseres Organismus auf pathogene Eindringlinge wie Bakterien, Viren oder Pilze darstellt, ist die chronische Entzündung immer Folge einer gestörten Immuntoleranz. Ein gesundes Immunsystem kann exogene Triggerfaktoren tolerieren und eine Entzündung dem Ausmaß der tatsächlichen Bedrohung anpassen. Bei chronischen Entzündungserkrankungen handelt es sich um eine andauernde Überreaktion des Immunsystems auf zumeist harmlose Triggerfaktoren.
Was bewirken die Triggerfaktoren?
Die Abbildung zeigt die Vielfalt möglicher relevanter Auslöser einer chronischen Entzündung und soll symbolisieren, dass bei einem Patienten oft mehrere gleichzeitig einwirkende Triggerfaktoren von Bedeutung sind. In Abhängigkeit von der vorliegenden Exposition (Belastung) und den individuellen Reizschwellen (individuelle Sensibilisierung und genetische Prädispositionen?) stören die auf den Organismus einwirkenden Triggerfaktoren die Regulationstetrade aus Immunaktivierung, oxidativem und nitrosativem Stress sowie der Mitochondrienfunktion. Diese Regulationstetrade ist das Brückenglied zwischen den endogenen und exogenen Umweltfaktoren und der bei chronischen Entzündungserkrankungen gestörten Immuntoleranz.

Mitochondriopathien sind Erkrankungen, die durcheine Fehlfunktion oder Schädigung der Mitochondrien verursacht werden. Sie manifestieren sich durch die reduzierte Fähigkeit zur Bereitstellung der Energie (in Form von ATP) in den Körperzellen.Es werden zwei Formen der Mitochondriopathien unterschieden: ererbte (primäre) und durch Umwelteinflüsse oder chronische Entzündungsprozesse erworbene Mitochondriopathien. Letztere werden als sekundäre Mitochondriopathien bezeichnet. Primäre Mitochondriopathien entstehen durch Mutationen in Genen, die für Strukturen oder den Stoffwechsel der Mitochondrien wichtig sind.Primäre Mitochondriopathien sind sehr selten,die Symptomatik ist meist schwer und die Erkrankungen werden frühzeitig diagnostiziert. Insbesondere Organe mit hohem Energieverbrauch wie Gehirn, Herz oder Skelettmuskulatur sind beeinträchtigt. Die Diagnose „Primäre Mitochondriopathie“ wird durch eine Muskelbiopsie und genetische Analysen gesichert. Bei Patienten mit chronischen Entzündungserkrankungen handelt es sich ausschließlich um die sekundäre (erworbene) Form.Die Diagnostik der sekundären Mitochondriopathie erfolgt durch die Messung des intrazellulären ATPsin aus dem Blut gewonnenen Leukozyten. Für die primäre Mitochondriopathie ist die Messung desintrazellulären ATP ohne Bedeutung.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 245
Das C-reaktive Protein (CRP) ist lediglich geeignet zum Nachweis einer akuten bzw. schwerwiegenden Entzündung, v. a. der akuten bakteriellen Infektion oder auch zum Nachweis einer Aktivitätsphase bei systemischen Autoimmunerkrankungen. CRP ist nicht geeignet zum Nachweis der Aktivierung des T-zellulären Immunsystems oder der Mastzellen, weil es in deren Mediatorkaskaden nicht vorkommt und allenfalls moderat durch Kreuzaktivierungen mit freigesetzt wird. Bei chronischen und latenten Verlaufsformen ist das CRP aber selbst zum Nachweis der myelomonozytären Entzündung zu wenig sensitiv, da es erst am Ende der Inflammationskaskade steht und nicht von den Entzündungszellen selbst, sondern von der Leber freigesetzt wird. Das betrifft auch das hoch-sensitive CRP, wo das CRP nur mit anderen Tests gemessen wird, welche den idealen Messbereich im niedrigeren Bereich haben. Zum Nachweis der latenten und chronischen myelomonozytären Entzündung ist der Tumor-Nekrose-Faktor-alpha (TNF-?) besser geeignet, da dieses Zytokin am Beginn der Entzündungskaskade steht. Allerdings sollte auch wegen der geringen Kosten das hochsensitive CRP möglichst immer mitbestimmt werden, denn es oft der Differenzierung zwischen bakteriellen und nicht-bakteriellen (viralen, allergenen) Prozessen dient.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 198
FAQ Kategorien
Häufig gestellte Fragen aus der Laborpraxis der klinischen Immunologie
Gern können Sie die gedruckte FAQ-Broschüre bei uns per E-Mail bestellen.

