Häufig gestellte Fragen (FAQ)
Allergie, Histamin & Mastzellen
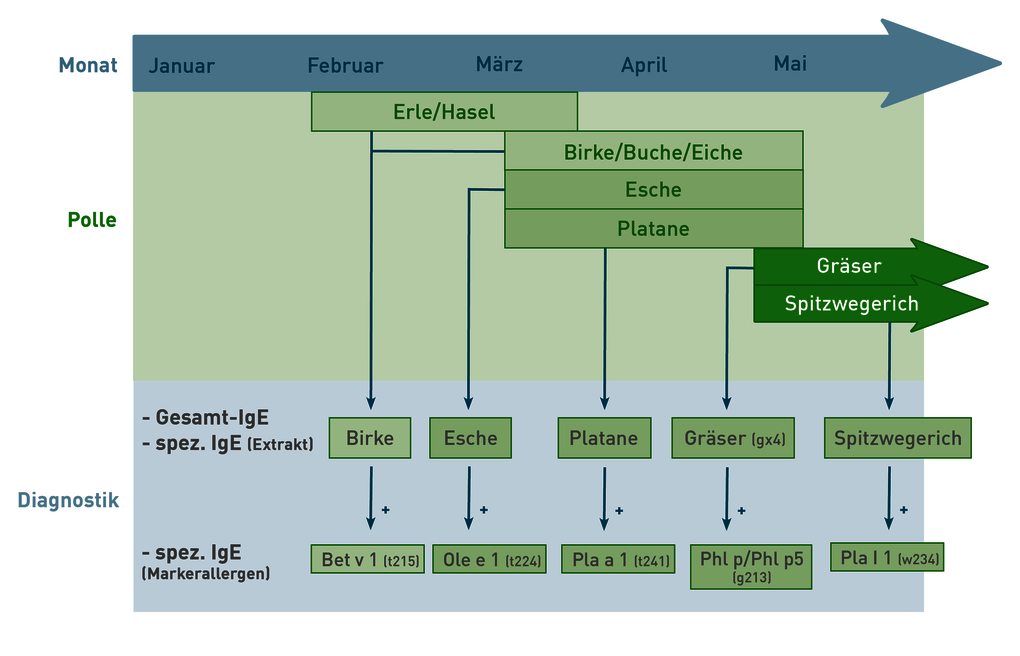
Bei Verdacht auf allergische Rhinitis oder Konjunktivitis im Frühjahr wird zur Diagnosestellung die Bestimmung von spezifischem IgE gegen potenzielle Allergene empfohlen. Gleichzeitig ist es ratsam, das Gesamt-IgE zu bestimmen, um die Ergebnisse besser interpretieren zu können. Ein Anteil an spezifischem IgE von mindestens 1% deutet in der Regel auf eine klinische Relevanz hin. Zu den Hauptauslösern gehören Baumpollen von Birken- und Buchengewächsen (wie Erle, Hasel, Birke, Buche und Eiche), deren Blütezeit bereits im Februar beginnt und bis in den Mai dauern kann. Da die Reaktion auf diese Pollen auf ein homologes Protein der PR-10 Protein-Familie zurückzuführen ist, ist die Bestimmung von spezifischem IgE gegen Birkenpollen in der Regel ausreichend. Alternativ können auch Platanen- und Eschenpollen ähnliche Symptome auslösen und sollten daher berücksichtigt werden. Die Saison der Süßgräser beginnt in der Regel Anfang Mai und umfasst Gräser wie Lieschgras, Roggen, Weizen, Gerste, Hafer und verschiedene Wiesen- und Feldgräser. Aufgrund großer Homologien zwischen diesen Gräsern reicht die Untersuchung von spezifischem IgE gegen eine Gräsermischung (gx4) oder ein repräsentatives Gras wie Lieschgras oder Roggen aus. Die Blütezeit von Spitzwegerich beginnt ebenfalls im Mai und erstreckt sich bis in den Sommer hinein. Da Pollenallergiker häufig gegen mehrere Pollen sensibilisiert sind, kann zur Erhöhung der Spezifität die zusätzliche Bestimmung von spezifischem IgE gegen bestimmte Markerallergene empfohlen werden. Ein positives Ergebnis auf diese Allergene deutet auf eine spezifische Sensibilisierung hin und kann eine Indikation für eine spezifische Immuntherapie sein (siehe Musterbefund). Zur Anforderung der Allergiediagnostik verwenden Sie bitte unseren Allergieschein (Link zum PDF).
Beeinflusst die Einnahme von Anti-Allergika Provokationstests in der Allergiediagnostik?
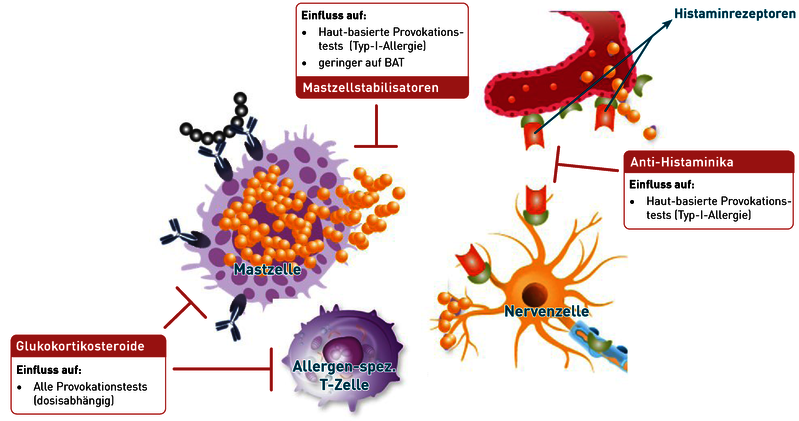
Provokationstests sind diagnostische Hilfsmittel zur Evaluierung einer Allergie und ihrer Ausprägung. Dabei soll die mögliche Reaktion auf ein Allergen nachgestellt werden, in vivo oder in vitro. Für die Typ-I-Allergie kommen hierzu der Pricktest (in vivo) oder der Basophilenaktivierungstest (BAT; in vitro) zum Einsatz; für die Typ-IV-Allergie der Epikutantest (in vivo) oder der Lymphozytentransformationstest (LTT; in vitro). Nicht selten stehen Patienten zum Zeitpunkt der Provokation unter Medikation mit Anti-Allergika, und es stellt sich daher die Frage nach einer möglichen Beeinflussung der Provokationstests:
- Bei Typ-I-Allergien werden häufig Anti-Histaminika wie Cetirizin oder Desloratadin angewendet. Sie blockieren Histaminrezeptoren an den Zielzellen und somit die Wirkung des Histamins, nicht aber seine Freisetzung. Das bedeutet, dass Antihistaminika weder die Histaminkonzentration im Blut noch das Ergebnis des BAT verändern, denn letzterer quantifiziert die Allergen-induzierte Freisetzung von Histamin und Leukotrienen aus Basophilen Granulozyten. Auf diesen Vorgang hat die Blockade der Histaminrezeptoren keinen Einfluss. Haut-basierte in vivo-Provokationstests für die Typ-I-Allergie, wie der Pricktest, detektieren hingegen die durch Histamin ausgelöste Hautreaktion (Quaddelbildung, Juckreiz, Rötung). Diese Histaminwirkung wird durch Anti-Histaminika deutlich beeinträchtigt. Ein Absetzen des Medikamentes mindestens 48h vor in-vivo-Testung ist somit angeraten.
- Eine weitere Wirkstoffgruppe der Antiallergika bilden Mastzellstabilisatoren wie Ketotifen. Diese hemmen die Ausschüttung von Typ-I-Mediatoren aus den Mastzellen. Topisch eingesetzte Mittel z.B. als Augentropfen, haben wenig bis gar keinen Einfluss auf den Pricktest oder den BAT. Allerdings ist die Sensitivität des Pricktests bei systemischer Einnahme durchaus vermindert. Je nach Dosis können zusätzlich auch die Basophilen Granulozyten beeinträchtigt sein und demnach die Aussagekraft des BAT.
- Provokationstest für die Typ-IV-Allergie, wie der LTT oder Epikutanstest, sind gänzlich unabhängig von Typ-I-Mediatoren, da hier Allergen-spezifische T-Zellen nachgewiesen werden.
- Glukokortikosteroide hingegen wirken unspezifisch immunsuppressiv und blockieren die Funktion vieler verschiedener Immunzellen, wodurch eine Beeinträchtigung der Sensitivität aller Provokationstests in Abhängigkeit der eingenommenen Dosis zu beobachten ist.
Vorweg: Histamin aus der Nahrung hat nahezu keinen Einfluss auf den Histaminspiegel im Blut. Wenn wirklich die klassischen Ursachen vermehrter Histaminbildung und auch ein reduzierter Histaminabbau (DAO-Aktivität) ausgeschlossen sind, dann sollte danach geschaut werden, ob eine Dysbiose-bedingte vermehrte Histaminbildung im Darm dafür verantwortlich ist. Verschiedene Bakterien, insbesondere Klebsiella pneumoniae, Morganella morganii und Hafnia alvia wandeln sehr effektiv das Histidin aus der Nahrung in Histamin um. Patienten, die eine vermehrte Ansiedlung dieser Bakterien im Darm haben, tragen im Grunde ihre eigene Histaminquelle immer mit sich. Vor allem wenn zusätzlich eine gestörte Darmbarriere vorliegt, kann Histamin leicht in das Portalblut übertreten und in den peripheren Blutkreislauf gelangen und einschlägige Symptome verursachen. Zur Abklärung dieser versteckten Quelle empfiehlt sich die Untersuchung "Histaminbildner im Stuhl". Ergänzend bieten sich die Stuhlanalysen Histamin, a-1-Antitrypsin (leaky gut-Marker) sowie das Eosinophile Protein X (EPX) an. Mit letzterem schließt man eine Eosinophilenaktivierung in der Darmwand aus, die (in seltenen Fällen) neben den Bakterien auch für erhöhte Histaminbildung im Darm verantwortlich sein könnte. Bei auffälligem Befund der Histaminbildner sollte die Dysbiose durch Darmreinigung (z.B. Flohsamenschalen, Aktivkohle, Oreganoöl, Pektin, Zeolith, u.a.), Präbiotika (z.B. Akazienfasern, Inulin, FOS, u.a.) und Probiotika ausgeglichen werden. Cave: viele Probiotika enthalten histaminbildende Bakterien, hier finden Sie weitere Informationen dazu. Zudem sollten vorübergehend nicht nur Histamin- sondern auch Histidin-reiche Nahrungsmittel reduziert werden. Diese sind: Fleisch (Rind, Schwein, Lamm, Huhn), Thunfisch und Lachs, ebenso Milch sowie Hartkäse, Bohnen, Linsen, Erdnüsse und Weizenkeime.
Unseren Anforderungsschein für die Stuhldiagnostik finden Sie hier.
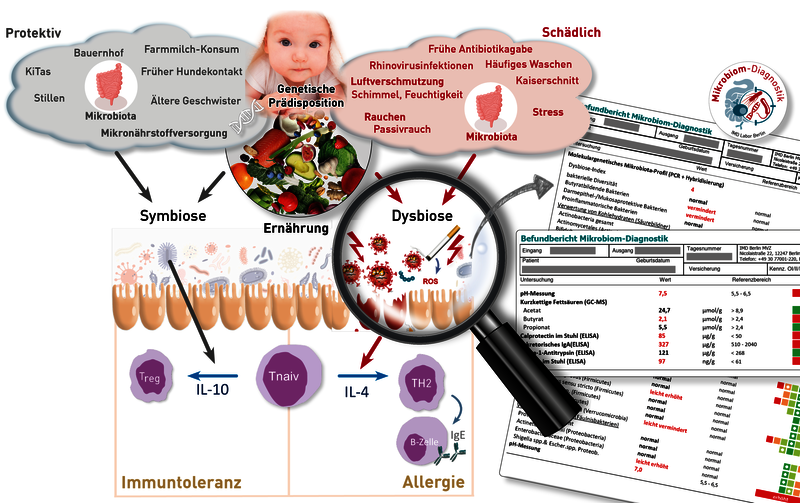
Dank großer epidemiologischer Studien ist mittlerweile klar: Mikrobiom und Umweltfaktoren spielen bei der Entstehung von Allergien eine zentrale Rolle. Ein harmonisches Zusammenspiel zwischen Darmmikrobiom und Immunsystem ist für die Immuntoleranz gegenüber Nahrungsmitteln und anderen harmlosen Umwelteinflüssen essentiell. Symbiose ist Voraussetzung für die Integrität der Darmbarriere, die regulierte Antigenpräsentation gegenüber dem adaptiven Immunsystem und letztlich die adäquate Bildung regulatorischer T-Zellen. Diese spielen eine zentrale Rolle für die Aufrechterhaltung der Immuntoleranz. Dysbiose und Leaky Gut führen zu einer unkontrollierten Exposition mit immunogenen Inhalten des Darmlumens und induzieren damit eine Immunaktivierung, die die Entstehung von Typ I- aber auch Typ IV-Allergien auf Nahrungsmittelbestandteile begünstigt. Wie erfolgt die Kommunikation zwischen Darmbakterien und Immunsystem? Hier spielen Stoffwechselprodukte des Mikrobioms eine wichtige Rolle: Beim Abbau von Ballaststoffen produzieren bestimmte Bakterienstämme kurzkettige Fettsäuren (Butyrat, Propionat, Acetat). Insbesondere Butyrat stärkt die Schleimhautbarriere und fördert die Induktion regulatorischer T-Zellen. Ein hoher Butyratgehalt im Stuhl im Säuglingsalter und eine ausreichende Anzahl an butyratbildenden Bakterien im Stuhl von Kindern sind mit einem signifikant geringeren Allergierisiko assoziiert.
Zur Allergieprävention im Säuglings- und Kindesalter ist aus diesen Gründen eine Untersuchung des Darmmilieus ratsam. In diesem Zusammenhang empfehlen sich folgende Analysen:
1. Kurzkettige Fettsäuren im Stuhl:
Auskunft über die aktuelle Acetat-, Propionat- und Butyratversorgung. Ein verminderter Wert deutet entweder auf eine unzureichende Zufuhr an präbiotischen Nahrungsmitteln oder auf eine reduzierte Funktion oder Anzahl an Butyratbildnern hin.
2. Molekulargenetisches Mikrobiota-Profil
Ermittelt u.a. die Stärke einer bakteriellen Dysbiose (Dysbioseindex) und das Vorkommen von Butyratbildnern im Stuhl des Patienten, sowie weitere für die Immuntoleranz wichtige Bakterien (z.B. Mukosaprotektive Bakterien). Bei sehr stark reduzierten Butyratbildnern empfiehlt sich neben prä- und probiotischer Behandlung ggf. zusätzlich eine temporäre Gabe von Butyrat.
3. pH-Wert (im molekulargenetischen Profil enthalten)
Ein alkalischer pH-Wert stört die Butyrat-bildenden Stoffwechselprozesse und kann auf einen Mangel an säurebildenden Bakterien hindeuten – es empfiehlt sich eine präbiotische Behandlung begleitet von einer Ernährungsumstellung.
Die Bestimmung von spezifischem IgE gegen Allergenmischungen (z.B. der Baum-, Gräser-, oder Kräuterpollenmischung) ermöglicht v.a. unter Berücksichtigung der Kosteneffizienz eine breitgefächerte Abgrenzung der möglichen Allergieauslöser. Im nächsten Schritt werden häufig die einzelnen Mischungen ausdifferenziert. Dieses Vorgehen ist jedoch aufgrund der Kreuzreaktivitäten nicht immer zielführend. Nicht selten weisen wir in solchen Fällen IgE gegen alle Bestandteile der Mischung nach. So ist z. B. bei dem Nachweis von spezifischem IgE gegen Phl p1 und Phl p5 aus dem Lieschgras davon auszugehen, dass bei der Einzeltestung auch positive Ergebnisse auf alle Süßgräserpollen erzielt würden (siehe hierzu Rubrik „Wissenschaft am IMD“). Darüber hinaus wird bei der Ausdifferenzierung der Mischungen häufig der Höchstwert überschritten.
Für die SIT-Planung aussagekräftig und zudem kosteneffizient ist vielmehr die direkte Bestimmung der IgE-Antikörper gegen einzelne rekombinante Allergenkomponenten. Das Befundbeispiel illustriert dieses Vorgehen: Stellvertretend für die Ausdifferenzierung der Gräserpollenmischungen werden die Markerallergene Phl p1 und Phl p5 bestimmt, stellvertretend für Ausdifferenzierung der Baumpollenmischung das Markerallergen Bet v1 der Birke und Buchengewächse. Die Bestimmung von Ole e1 dient als Marker einer spezifischen Sensibilisierung auf Eschenpollen. Letztere blühen in Deutschland meist zur selben Zeit wie die Birke und können symptomatisch einer Birkenpollenallergie ähneln.
Mehr Informationen im Detail zur klinischen Aussagekraft der molekularen Allergiediagnostik finden sie auch hier.

Immunglobulin E (IgE) ist im menschlichen Organismus hauptsächlich an Rezeptoren auf den Oberflächen von Mastzellen sowie von eosinophilen und basophilen Granulozyten gebunden. Seine Hauptfunktion ist die Abwehr von parasitären Infektionen (z.B. Helminthen und Protozoen). Die Bindung passender Antigene an zellgebundene IgE-Antikörper führt zur Ausschüttung von Histamin, Leukotrienen, Prostaglandinen und diversen weiteren proentzündlichen Mediatoren, welche essentiell für die Bekämpfung einer Parasitose sind. Richten sich die IgE-Antikörper fälschlicherweise gegen eigentlich harmlose Substanzen aus unserer Umwelt (z.B. Pollen, Nahrungsmittel), kann das zu Allergien führen. Richten sie sich gegen körpereigene Proteine, können sie Auslöser von Autoimmunerkrankungen (z.B. Urtikaria) sein.
Ist das Gesamt-IgE erhöht, kann das zwar auf eine floride Allergie hindeuten (allergische Rhinitis, Neurodermitis, Asthma oder Nahrungsmittelallergie), dennoch eignet sich das Gesamt-IgE nicht als Screening-Parameter bei Allergie-Verdacht, da es auch bei parasitären Infektionen, Autoimmunerkrankungen sowie diversen Immundefekten und Krebserkrankungen erhöht sein kann.
Liste möglicher assoziierter Erkrankungen
Bei allergologischer Fragestellung sollte daher neben dem Gesamt-IgE immer das spezifische IgE gegen den verdächtigten Auslöser bestimmt werden. Die parallele Untersuchung des Gesamt-IgE ermöglicht in diesem Fall eine optimierte Beurteilung der Ergebnisse. Ein spezifisches IgE ist wahrscheinlich dann von klinischer Relevanz, wenn es über 1% des Gesamt-IgE ausmacht. Auch bei einem erniedrigten Gesamt-IgE sollte eine weitere Abklärung erfolgen, denn dies könnte auf einen variablen Immundefekt hindeuten. Weitere Details über die Relevanz des Gesamt-IgE in der Labordiagnostik bietet Ihnen die neue Diagnostikinformation 341.
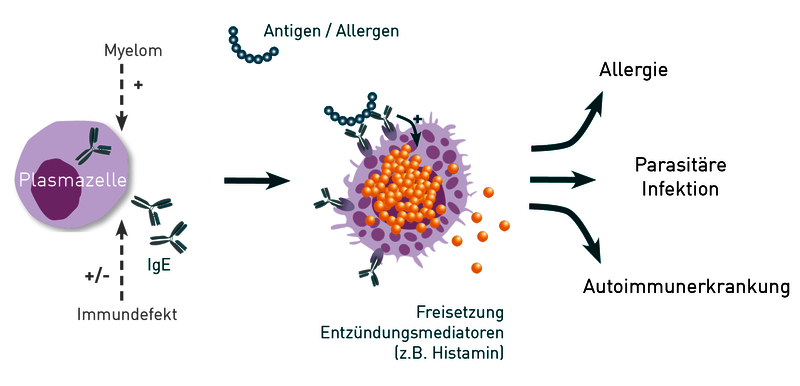
Abb.: Zellgebundene IgE-Antikörper erkennen spezifische Antigene und spielen so eine Rolle in der Bekämpfung parasitärer Infektionen aber auch bei Allergien und Autoimmunerkrankungen. Immundefekte und Krebserkrankungen können die Produktion von IgE-Antikörpern durch Plasmazellen beeinflussen.
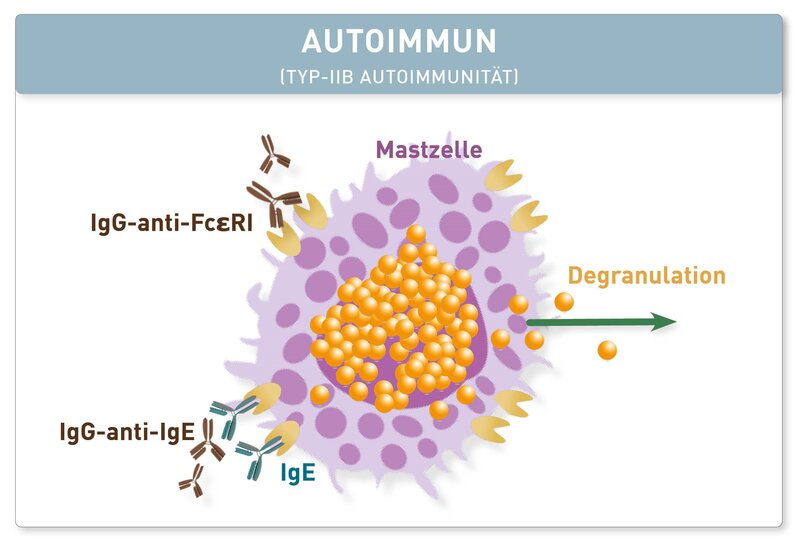
Die Urtikaria ist ein häufiges Krankheitsbild der Haut, bei dem es durch verschiedenartige Auslöser zur vermehrten Freisetzung von vasoaktiven Mediatoren (z.B. Histamin) aus den Haut-Mastzellen kommt. Als Folge entstehen juckende Rötungen, Quaddeln und/oder Angioödeme. Bleiben die Symptome länger als 6 Wochen bestehen, spricht man von einer chronischen Urtikaria. Häufigster Typ ist die Chronisch Spontane Urtikaria (CSU), bei der die Degranulation der Mastzellen oft über autoimmune Mechanismen ausgelöst wird, wie z.B. bei der CSU vom Typ IIb durch IgG-Antikörper, die gegen das körpereigene IgE oder den IgE-Rezeptor gerichtet sind (siehe Abbildung). Das Diagnosekriterium einer Typ-IIb-CSU ist bisher der sogenannte autologe Serumtest, bei dem das patienteneigene Serum in die Haut injiziert und die mögliche Quaddelbildung beobachtet wird. Solche Tests können für den Patienten sehr unangenehm sein und sind z.B. unter Anti-Histaminika-Einnahme beeinträchtigt. Der Basophilen Degranulationstest (BDT) bietet als „in vitro Provokationstest“ entscheidende Vorteile. Sind im Patientenserum die Autoantikörper gegen das auch auf den Basophilen Granulozyten gebundene IgE oder den IgE-Rezeptor vorhanden, so führt dessen Bindung daran unmittelbar zur Freisetzung der klassischen Mediatoren, zu denen auch die Leukotriene gehören. Diese werden im BDT gemessen. Somit kann der risikobehaftete in-vivo-Test vermieden werden. Ist die Typ IIb-CSU nachgewiesen, kann der Behandler seine Therapie dem Schweregrad entsprechend anpassen und z.B. die kontinuierliche Dosis an Antihistaminika erhöhen, da häufiger mit Angioödemen zu rechnen ist. Des Weiteren können Therapien mit anti-IgE-Ak (z.B. Omalizumab, Ligelizumab) zum Einsatz kommen, die direkt die Bindung von IgE an den IgE-Rezeptor erschweren und indirekt zur Verringerung der IgE-Rezeptoren an der Zelloberfläche führen. Aufgrund des hohen Leidensdrucks von CSU- Patienten ist in jedem Fall eine Diagnostik zur Ursachenfindung angeraten. Weitere Details über die CSU und die Durchführung der Laboruntersuchung bietet Ihnen die neue Diagnostikinformation 338.
Durch eine Impfung soll unsere körpereigene Abwehr ein immunologisches Gedächtnis gegen einen bestimmten Krankheitserreger aufbauen. Grundlage dafür ist, dass der Impfstoff im Körper eine spezifische Immunreaktion auslöst. Diese kann lokal zu klassischen Symptomen wie Schwellung, Schmerzen und Rötungen führen sowie auch systemisch zu allgemeinem Krankheitsgefühl mit Fieber und Gliederschmerzen.
Unter sogenannten „Impfkomplikationen“ werden hingegen schwerwiegende Reaktionen des Körpers verstanden, die nicht wie die üblichen zuvor genannten Symptome nach wenigen Tagen problemlos abklingen und sogar gesundheitliche Schäden verursachen können (Impfschaden). Ebenso wie jegliche Immunreaktion auf einen Infektionserreger, können solche Impfkomplikationen mit keinem Labortest vorhergesagt werden.
Allerdings kann eine bestehende Unverträglichkeit in Form einer Allergie auf einen Impfstoffbestandteil eruiert werden. Generell stellen aber allergische Reaktionen auf Impfstoffbestandteile eine eher seltene Ursache von Impfkomplikationen dar.
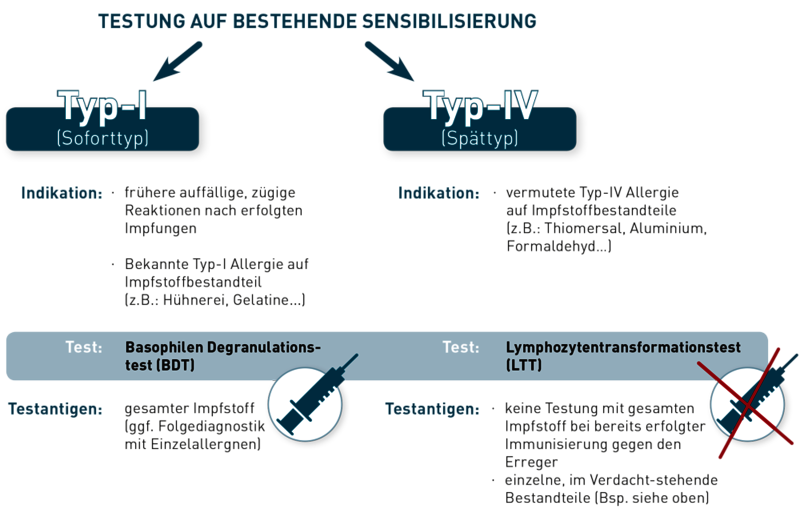
Besteht der Verdacht auf eine Typ-I-Allergie (Soforttyp), bzw. ist bereits eine Typ-I-Allergie auf einen potentiellen Impfstoffbestandteil bekannt, so kann hier der Basophilen-Degranulationstest (BDT) angewendet werden. In diesem „in-vitro-Provokationstest“ werden die patienteneigenen Basophilen Granulozyten mit dem eingesandten Impfstoff konfrontiert und eine daraufhin vermehrte Freisetzung von Leukotrienen kann eine individuelle Sensibilisierung nachweisen.
Auch sogenannte Spättyp-Reaktionen (Typ-IV) können nachgewiesen werden. Hier kommt der Lymphozytentransformationstest (LTT) zum Einsatz. Bei bereits erfolgter früherer Immunisierung ist eine Unverträglichkeitstestung mittels LTT auf den entsprechenden Impfstoff nicht mehr sinnvoll. Hier kann dann nicht mehr zwischen einer bestehenden und durch die Impfung erwünschten zellulären Gedächtnisantwort auf das Impfantigen und einer Typ-IV-Sensibilisierung auf einen Impfstoffbestandteil unterschieden werden! In einem solchen Fall wäre die einzelne Testung auf die jeweils verdächtigen Zusatz- bzw. Beistoffe ratsam.
Es ist zu beachten, dass sowohl der LTT, als auch der BDT lediglich bestehende Sensibilisierungen nachweisen können und keine Vorhersage über sich zukünftig entwickelnde Allergien erlauben.
Die folgende Abbildung soll den Einsatz solch zellulärer in vitro Allergietests im Fall von Impfstoffen nochmal zusammenfassen und verdeutlichen.
Die molekulare oder auch komponentenbasierte Allergiediagnostik identifiziert nicht nur die Allergenquelle, sondern die für die Sensibilisierung relevanten Proteinmoleküle (= „Komponenten“).
Die Komponenten werden auf Grundlage von strukturellen Ähnlichkeiten in verschiedene Familien unterteilt. Die Zuordnung der Sensibilisierung eines Patienten zur auslösenden Allergenfamilie ist klinisch relevant. So bedingt im Falle der Erdnuss die Sensibilisierung auf die Speicherproteine (z. B. Ara h 1,2,3) ein erhöhtes Risiko für schwere allergische Reaktionen, während eine alleinige Sensibilisierung auf das PR10-Protein Ara h 8 eine birkenpollenassoziierte Sensibilisierung anzeigt, die in erster Linie mit oralen allergischen Symptomen verbunden ist. Gerade bei Pollenallergikern ermöglicht die komponentenbasierte Diagnostik eine Differenzierung spezifischer Pollensensibilisierungen von Kreuzreaktivitäten mit Nahrungsmitteln, Kräuter- oder Baumpollen (Abb 1).
Eine Einzeltestung bestimmter Allergenkomponenten ist mit dem RAST (UniCAP-Test) möglich. Für polysensibilisierte Patienten mit einem komplexen klinischem Bild bietet sich als kosteneffiziente Alternative das ALEX IgE-Allergenscreening an, welches 125 Allergenkomponenten und 175 Allergenextrakte erfasst. Dieses kann auch zusätzliche Informationen über Sensibilisierungen liefern, die unterhalb der Symptomschwelle liegen und somit durch die Anamnese nicht erfasst werden, jedoch zum atopischen Gesamtbild entscheidend beitragen können (Abb. 2).

Dass in Einzelfällen 20 ml Heparinblut nicht ausreichen, liegt daran, dass der Lymphozytentransformationstest (LTT) nicht mit Vollblut durchgeführt wird, sondern dass aus dem Patientenblut Lymphozyten und Monozyten (sogenannte Mononukleäre Zellen) isoliert werden. Hier lassen sich mal mehr und mal weniger Zellen gewinnen. Beim LTT werden pro Allergen ca. 600.000 Mononukleäre Zellen benötigt. Um eine perfekte Sensitivität sicherzustellen, machen wir hier keine Abstriche. Die Isolationsausbeute, d. h. die Zahl der vitalen Lymphozyten, die gewonnen werden kann, hängt davon ab, wie viele Lymphozyten der Patient im Blut hat. Bei deutlicher Lymphozytopenie kann es knapp werden. Manchmal ist aber auch die Qualität der Zellen ausschlaggebend, denn nur intakte und vitale Einzelzellen gehen in die Ausbeute ein. Bei Erkrankungen, die mit Immunaktivierung einhergehen, kann es in seltenen Fällen dazu kommen, dass durch Migration der Immunzellen ins Gewebe ihre Zahl im Blut abnimmt. Auch eine unzulässige Probenkühlung während des Transports ins Labor kann die Zellzahl deutlich reduzieren. Einige Medikamente können ebenfalls diesen Effekt verursachen. Deshalb empfehlen wir im Winter nicht nur einen kontrollierten temperierten Bluttransport per Kurier (keine Posteinsendung!) sondern auch, wenn möglich, ein Röhrchen Heparinblut mehr einzusenden. Das gibt dem Labor eine Reserve, falls diese nötig wird.

Bei Verdacht auf Schimmelpilzallergie vom Typ I oder Typ IV nutzen viele Umweltmediziner die Möglichkeit, direkt auf die im Wohnumfeld des Patienten angezüchteten Schimmelpilze zu testen. Das ist sowohl im Lymphozytentransformationstest (LTT) als auch im Basophilen-Degranulationstest (BDT) möglich. Der Vorteil ist, dass man so für den betreffenden Patienten eine klare Aussage machen kann, ob er auf irgendeinen in seinem Umfeld vorhandenen Pilz allergisch reagiert. Bei der Vielzahl möglicher Spezies und dem eingeschränkten Spektrum der Standardallergiediagnostik ist dieses sehr hilfreich. Bei einem positiven Befund in den Nativ-Allergietests ist es nachgewiesen, dass das häusliche Umfeld des Patienten für ihn eine individuell relevante Schimmelpilz-allergene Belastungsquelle darstellt.
Diese Anzuchtplatten bzw. die darauf gewachsenen Schimmelpilze eignen sich dagegen nicht für die mykologische Differenzierung, also die taxonomische Bestimmung der gewachsenen Schimmelpilze. Dafür wäre eine standardisierte Probensammlung essentiell. Mit dem für die Allergietestung etablierten „Sammelverfahren“ durch bloßes Aufstellen der geöffneten Platten, können keine quantitativen Rückschlüsse gezogen werden, und es kann daher nicht zwischen mengenmäßig relevanten und irrelevanten Belastungen unterschieden werden. Das Ausmaß des Bewuchses der Sabouraud-Agar-Platten ist eher vom Wachstumsverhalten abhängig als vom ursprünglichen Sporeneintrag auf der Platte. Obwohl technisch möglich, wäre daher die Bestimmung der Schimmelpilzkolonien auf diesen Platten vor Vermietern, Gerichten oder Behörden, trotz hoher Kosten, wertlos. Die Probensammlung, die Anzucht sowie die Differenzierung muss auf die baubiologischen Fragestellungen angepasst sein und sollte deshalb durch einen Sachverständigen oder Baubiologen erfolgen.

Antihistaminika wie z. B. Cetirizin und Loratadin sind Wirkstoffe, welche die Wirkung körpereigenen Histamins abschwächen oder aufheben, indem sie Histamin-Rezeptoren blockieren. Sie beeinflussen jedoch nicht die Freisetzung und den Abbau des Histamins und wirken sich damit nicht auf den Histaminspiegel im Blut aus.
Bei Typ-I-Allergikern ist in erster Linie die Freisetzung des Histamins durch Mastzellen für die bekannte Symptomatik verantwortlich. Da ein hautbasierter Allergietest (z. B. Prick-Test) auf der Grundlage der durch Histamin ausgelösten Hautreaktion beruht, sind die Medikamente in diesem Fall wenigstens 48 Stunden vor Durchführung des Testes abzusetzen.
Auf die Labordiagnostik hingegen haben Antihistaminika aus folgenden Gründen keinen Einfluss:
- Im RAST werden allergen-spezifische IgE-Antikörper bestimmt, diese Diagnostik ist Histamin unabhängig.
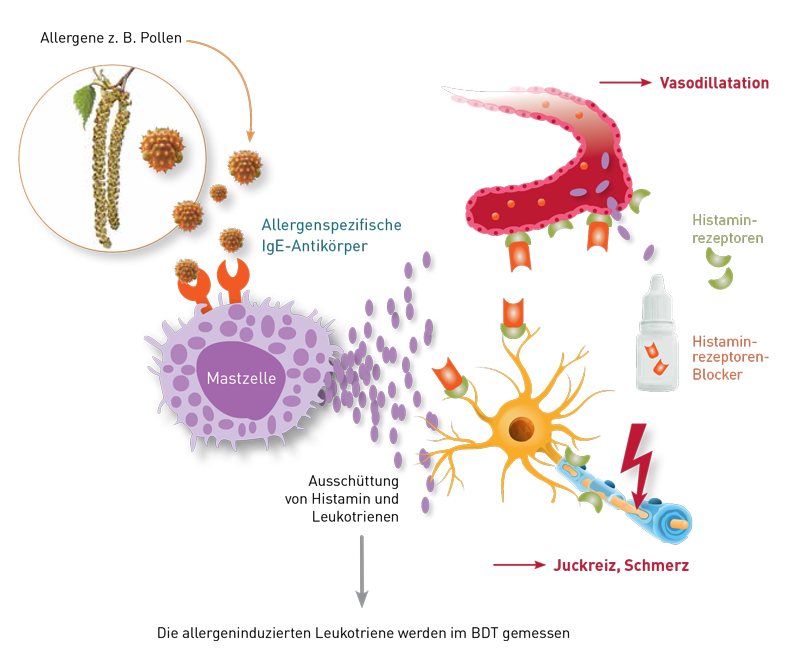
- Im BDT kann die allergen-induzierte Histamin- und/oder Leukotrienfreisetzung problemlos bestimmt werden, da Antihistaminika als Histaminrezeptorenblocker lediglich die Wirkung des Histamins an deren Zielzellen blockieren, nicht aber die Aktivierung oder die Funktionalität der basophilen Granulozyten (siehe Abbildung unten)
- Im LTT wird zum Nachweis der Typ-IV-Allergie die Vermehrung antigen-spezifischen T-Lymphozyten bestimmt, auch diese ist Histaminrezeptor-unabhängig.

Nein, da Antihistaminika als Histaminrezeptorenblocker lediglich die Wirkung des Histamins an deren Zielzellen blockieren, nicht aber die Aktivierung oder die Funktionalität der Mastzellen und basophilen Granulozyten. Im Falle einer vorliegenden Typ I Sensibilisierung lässt sich im Labor auch unter Antihistaminika die allergeninduzierte Histamin-aber auch Leukotrienfreisetzung problemlos bestimmen. Eine mögliche Einschränkung der Auswertbarkeit können dagegen Mastzellstabilisatoren (Cromoglicinsäure, Nedocromilnatrium) haben. Diese sollten wenn möglich 7 Tage vor der Blutentnahmeabgesetzt werden. Antihistaminika haben übrigens aus dem oben genannten Grund auch keinen Einfluss auf den Histaminspiegel im Blut, Mastzellstabilisatoren dagegen schon.
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 122
Er spielt in der Praxis keine wichtige Rolle. Methylhistamin im Sammelurin wird gern im Rahmen von Provokationstests gemessen, um den Anfall von Histamin im Organismus zu objektivieren. Bei aufwändigen und nicht ungefährlichen Provokationstests z. B. auf Medikamente oder Nahrungsmittel verlässt man sich ungern allein auf subjektive Angaben des Patienten.
Wo das Methylhistamin herkommt, ist aus der Graphik zu entnehmen. Es kommt nicht aus dem Abbau über die Diaminooxidase (DAO), sondern aus dem zweiten Abbauweg, nämlich der Histamin-N-Methyltransferase (HNMT, rechte Seite).
Da ca. 8 % der Bevölkerung einen HNMT-Mangel haben, könnte bei diesen der Parameter Methylhistamin im Urin im Rahmen von Provokationstests ohnehin unbrauchbar sein. Methylhistamin im Urin wird zudem manchmal an Stelle des Histamins im (Heparin)Blut empfohlen, z. B. bei Verdacht auf Mastzellaktivierungssyndrom oder auch Mastzell-assoziierter Entzündung. Das ist aber kritisch zu sehen. Der Parameter ist (ganz abgesehen von den o.g. 8 % mit HNMT-Mangel) zu wenig sensitiv für diese Fragestellung. Sogar bei Allergikern mit deutlichen Symptomen kommen erhöhte Werte selten vor.
Das liegt zum einen daran, dass die korrekte Präanalytik oft nicht eingehalten wird. Der Urin muss über 24 h, mindestens aber 12 h gesammelt werden, da Methylhistamin über die Niere nicht konstant ausgeschieden wird. Zum zweiten (gut erkennbar in der Graphik) wird Methylhistamin weiter zu N-Methyl-Imidazolessigsäure abgebaut und dieses weiter in zahlreiche andere Substanzen. Darum muss der Urin über Salzsäure gesammelt werden. Wenn das nicht ordnungsgemäß erfolgt, resultieren (falsch) normale Werte.
Insgesamt hat sich zum Nachweis der Mastzellassoziierten Entzündung (auch bei Mastzellaktivierungssyndrom) die Bestimmung von Histamin im Heparinblut als der sensitivste und sicherste Labormarker erwiesen. Bei Verdacht auf ein Mastzellaktivierungssyndrom sollten zusätzlich Tryptase, TGF-β, Serotonin und Leukotriene im Urin bestimmt werden, da Histamin nicht der einzige symptomauslösende Mastzellaktivierungsmarker ist.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Diese Empfehlung betrifft vor allem die sekundäre HIT. Diese ist definiert durch eine verminderte DAO-Aktivität trotz unauffälliger DAO-Genetik. Kupfer ist essentiell für die Funktion des histaminabbauenden Enzyms Diaminooxidase (DAO), da es als Zentralatom das aktive Zentrum des Enzyms stabilisiert. Somit kann ein Mangel an Kupfer die DAO-Aktivität herabsetzen (funktioneller DAO-Mangel) und verantwortlich für einen Histaminanstieg oder eine prolongierte Histaminwirkung sein.
Die Kontrolle der Kupferversorgung erfolgt über die Vollblutmineralanalyse (EDTA-Blut). Der Serumspiegel
ist nicht aussagekräftig, da bei Entzündungserkrankungen jeglicher Art durch Anstieg des Kupfertransportproteins Coeruloplasmin falsch erhöhte Werte trotz bestehendem Kupfermangels gemessen werden.
Wichtig: Im Unterschied zu einem genetisch bedingten DAO-Mangel ist ein funktioneller DAO-Mangel nur zu erfassen, wenn auch tatsächlich die DAO-Aktivität bestimmt wird. Leider wird in Folge der Kostenreduzierung von immer mehr Laboren nur noch die Mengenbestimmung der DAO mittels ELISA angeboten. Damit wird der funktionelle DAO-Mangel z. B. bedingt durch Kupfermangel, nicht erfasst.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Diese Frage haben wir vielfach gestellt bekommen. Der Grund ist eine weitreichende Verunsicherung, die dadurch bedingt ist, dass eine Reihe von Laboren in Deutschland einen seit 2014 verfügbaren, sehr einfach durchzuführenden DAO-ELISA-Test neu eingeführt haben.
Wir führen im IMD weiterhin den aufwändigeren DAO-Aktivitätstest (DAO-REA® der Firma Sciotec) durch.
Im Vergleich zur reinen Enzymmengenbestimmung mittels ELISA misst der DAO-Aktivitätstest die AKTIVITÄT der DAO anhand des Abbaus des Histaminanalogons Putrescin und erfasst deshalb nicht nur den genetisch bedingten DAO-Mengendefekt (primärer DAO-Mangel), sondern auch die gestörte DAO-Enzymfunktion (sekundärer DAO-Mangel).
Letztere ist für ca. 50 % der DAO-Funktionsverluste verantwortlich, so z. B. für alle sekundären Histaminintoleranzen durch Medikamentenblockaden, durch Kupfermangel oder Vitamin B6-Defizite. Mit dem DAO-ELISA-Test werden dagegen nur die primären (genetisch bedingten) Mangelzustände erfasst.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 118
Beide Erkrankungen beruhen im wesentlichen auf einem Missverhältnis zwischen wirksamem Histamin im Organismus und dem Histaminabbau. Die Folge ist bei beiden Erkrankungen eine verstärkte Wirkung des Entzündungsmediators Histamin an den Histaminrezeptoren 1 bis 4. Symptome sind u. a. anfallsweise Fatigue, Flush, Diarrhoe, Übelkeit, Kopfschmerzen, Hitzegefühl und Asthma. Des Weiteren können aber auch Ekzeme, Rhinitis, Urtikaria, Hypertonie, Herzrhythmusstörungen und Colitis auftreten.
Von einer Histaminintoleranz (HIT) spricht man, wenn für die verstärkte und verlängerte Histaminwirkung der gestörte Histaminabbau verantwortlich ist. Die HIT sollte man nicht zu den Nahrungsmittelunverträglichkeiten zählen, weil auch endogen gebildetes Histamin (z. B. bei Typ I-Allergikern oder Parasitosen) zur Histaminbelastung des Organismus beiträgt. Im Gegensatz zur HIT liegt beim Mastzellaktivierungssyndrom (MAS) die verstärkte Freisetzung von Mastzellmediatoren daran, dass die Mastzellen eines Patienten zu leicht unspezifisch aktivierbar sind und schon bei geringen Reizen Histamin und andere Mastzellmediatoren freisetzen.
Die Labordiagnostik bei HIT erfolgt über die Bestimmung der Aktivität des histaminabbauenden Enzyms Diaminooxidase. Parallel wird Histamin im Heparin-Vollblut bestimmt. Bei Verdacht auf MAS ist die DAO meist normal oder sogar erhöht (weil das Enzym durch permanent erhöhtes Histamin induziert wird). Labordiagnostische Marker für das MAS sind neben dem erhöhten Histamin, erhöhte Werte für ECP, Tryptase oder TGF-β sowie für die Leukotriene C4, D4 und E4 im Urin.

FAQ Kategorien
