Häufig gestellte Fragen (FAQ)
Immunfunktion & Autoimmunität
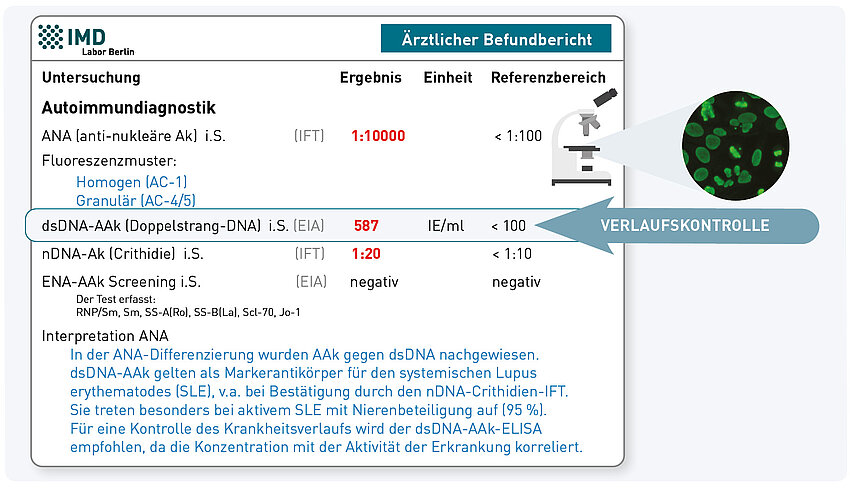
ANA (anti-nukleäre Antikörper) gelten als diagnostische Marker-Antikörper für systemische rheumatische Autoimmunerkrankungen (Kollagenosen). Diese Autoantikörper sind jedoch nicht spezifisch, was bedeutet, dass sie auch bei Personen ohne rheumatische Erkrankung vorkommen können. Zur Einordnung des Laborbefundes ist es wichtig, neben dem ANA-Titer auch das Fluoreszenzmuster des ANA zu beachten. Eines der häufigsten Muster ist das sogenannte „dicht fein granuläre“ Muster (AC-2). Es wird durch Antikörper gegen das Protein DFS70 verursacht. Diese ANA sind nicht krankheitsspezifisch und kommen bei gesunden Menschen sogar häufiger vor als bei Patienten mit entzündlich-rheumatischen Autoimmunerkrankungen. Werden ausschließlich DFS70-Antikörper nachgewiesen, ohne weitere für Kollagenosen typische ANA (zum Beispiel dsDNA-Antikörper) und ohne passende Beschwerden, spricht der Befund eher gegen das Vorliegen einer Kollagenose! Daher dürfen positive ANA nicht automatisch als „Rheuma“ interpretiert werden, sondern sollten immer ihrem Fluoreszenzmuster entsprechend differenziert werden.

ANA ist ein Sammelbegriff für eine Vielzahl von Autoantikörpern (AAk), die sich gegen unterschiedliche Antigene der Zelle (Zellkern, Zytoplasma) richten. Auch wenn der ANA-Titer für die Bestätigung der Diagnose einer systemischen autoimmunen Rheumaerkrankung bedeutsam ist, besitzt er weder eine absolute Krankheitsspezifität noch ist er als Aktivitätsmarker bzw. Verlaufsparameter geeignet. Für den ANA und einige andere AAk gilt, dass sie nicht direkt pathogenetisch wirksam sind, sondern eher spezifische T-Lymphozyten für die Zerstörung von Organstrukturen verantwortlich sind. Diese T-zellulär vermittelte Krankheitsaktivität wird über AAk-Titer nicht erfasst.
Ausnahmen stellen bestimmte ANA-Subspezifitäten dar, die mittels ANA-Differenzierung ermittelt werden. So können z.B. dsDNA-AAk bei systemischem Lupus erythematodes, Jo-1-AAk bei autoimmuner Myositis und U1-RNP-AAk bei der Mischkollagenose zur Beurteilung der Krankheitsaktivität herangezogen werden.
Nein, im Blut persistierend hohes oder sogar ansteigendes TNF-alpha bedeutet nicht, dass die Therapie nicht wirkt. Der TNF-alpha-Blutwert ist zur Therapiekontrolle nicht geeignet.
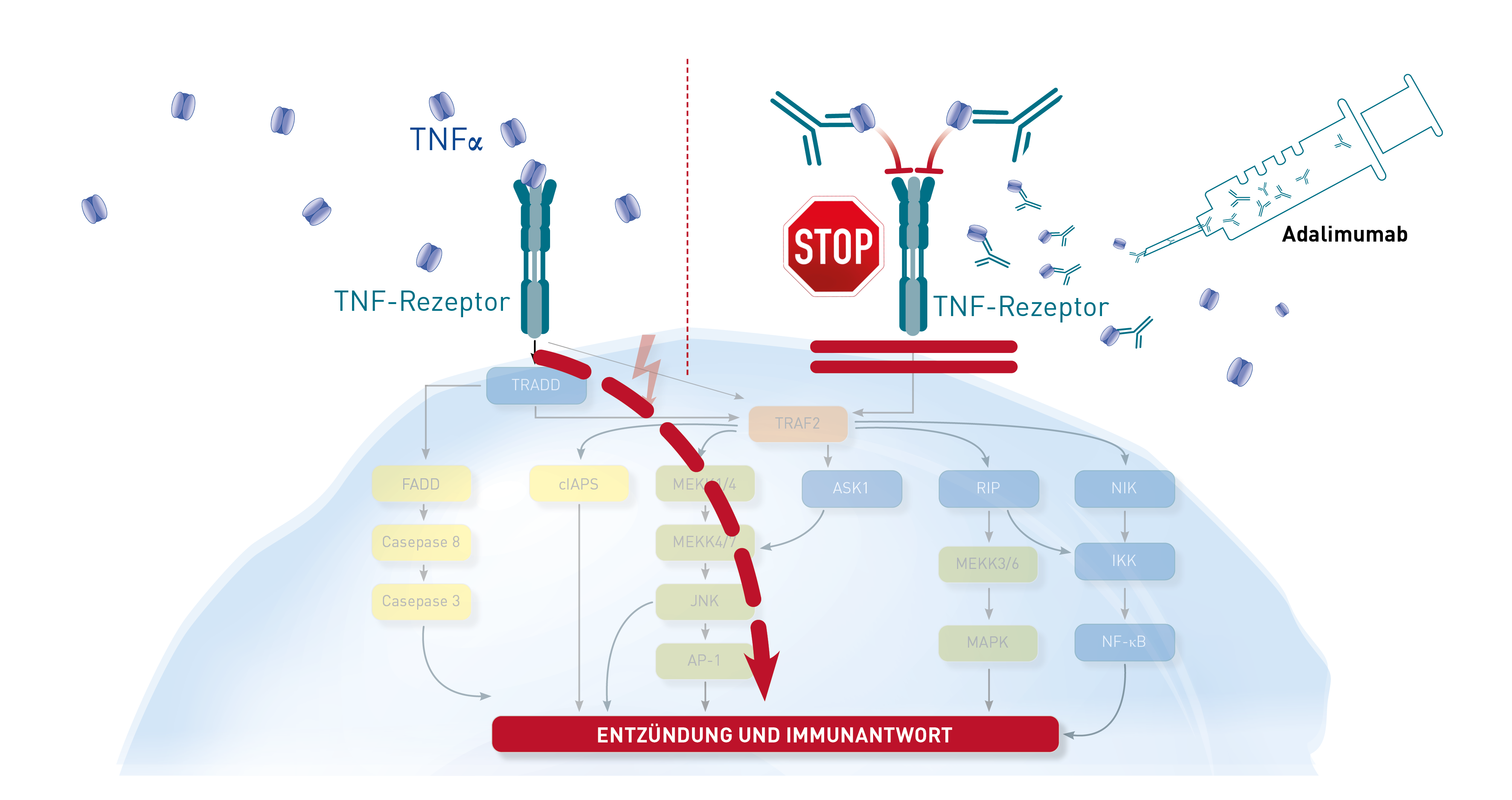
Das Entzündungszytokin TNF-alpha vermittelt seine proentzündliche Wirkung, indem es an die TNF-alpha-Rezeptoren auf seinen Zielzellen bindet. Auf diese Weise aktiviert es den Transkriptionsfaktor NF-κB, Proteasen (Caspasen) und Proteinkinasen (c-Jun N-terminale Kinase, MAP-Kinase). Diese Wirkung aktiviert die Zielzellen, was zu einer Entzündungs- und Immunantwort führt.
Die als TNF-Blocker verwendeten monoklonalen Antikörper Infliximab (Remicade®), Adalimumab (Humira®), Golimumab (Simponi®) genau wie das FAB-Fragment Certolizumab Pegol (Cimzia®) und das gentechnologisch hergestellte Protein Etanercept (Enbrel®) binden selektiv an TNF-alpha und zwar an den Teil des TNF-Moleküls, über den normalerweise die Bindung an die membrangebundenen TNF-Rezeptoren I oder II erfolgt. Keiner der genannten Antikörper hemmt die Bildung von TNF-alpha in Makrophagen, so wie das z. B. Kortison macht.
Der für die Bestimmung des TNF-Blutspiegels im Labor verwendete ELISA-Test nutzt einen "Fängerantikörper", der an eine andere Stelle des TNF-Moleküls bindet. Diese Stelle bleibt trotz der wirkungsneutralisierenden Anheftung der therapeutischen Antikörper frei, weshalb der TNF-Labortest sowohl Antikörper-gebundene als auch verbliebene freie TNF-alpha-Moleküle detektiert.
Der Grund, warum der TNF-Blutspiegel unter Therapie sogar häufig ansteigt, ist durch die fehlende negative Rückkopplung zu erklären. Physiologisch erhalten Makrophagen über ihre eigenen TNF-Rezeptoren auf der Oberfläche Signale, dass genügend TNF vorhanden ist. Da durch den therapeutischen Antikörper aber auch die rückkoppelnden TNF-Rezeptoren auf Makrophagen blockiert werden, geht der negative Feedback-Mechanismus verloren. Infolgedessen sezernieren die "falsch informierten" Makrophagen noch mehr TNF-alpha. Das zeigt aber letztlich keine entzündliche Wirkung, weil der therapeutische Antikörper auch diese Moleküle wieder neutralisiert und am TNF-Rezeptor wirkungslos macht.
Nein. Der Rheumafaktor (RF) ist nicht nur bei Rheumatoider Arthritis (RA), sondern auch bei zahlreichen anderen Erkrankungen nachweisbar. Positive Titer können sogar, meist in geringen Konzentrationen, bei Gesunden auftreten, insbesondere bei über 60-Jährigen. Umgekehrt schließt ein negativer RF-Befund eine Rheumatoide Arthritis (RA) nicht aus, denn RF kommen nur bei ca. 70-80 % der Patienten vor. Dennoch ist der RF einer der bekanntesten immunologischen Laborparameter in der Diagnostik der RA und weiterhin Bestandteil der Klassifikationskriterien. In Kombination mit den frühzeitig nachweisbaren und hochspezifischen ACPA (anti-citrullinierte Protein/Peptid-Antikörper), auch als CCP-Autoantikörper bekannt, wird die diagnostische Spezifität einer RA auf nahezu 100 % erhöht. Auch deutlich positiv nachweisbare IgM-RF gelten ähnlich wie die CCP-AAk als hochspezifisch für die RA.
Bei Patienten mit eindeutiger klinischer Synovitis in mindestens einem Gelenk und unklarer Ätiologie ist es hilfreich, Klassifikationskriterien zu nutzen, die mittels Punktesystem die Beurteilung dieser Patienten vereinfachen (Aletaha et al., 2010). Diese vom American College of Rheumatology (ACR) und der European League Against Rheumatism (EULAR) entwickelten Kriterien dienen der Diagnosestellung einer RA und sind in der nachfolgenden Tabelle aufgeführt.
Das Spikeprotein befindet sich auf der Oberfläche des SARS-CoV-2-Virus und dient diesem zum Eintritt in eine Wirtszelle. Dabei fungiert das ACE 2 (Angiotensin Converting Enzyme 2) als Haupt-Rezeptor. Dieser Mechanismus machte das Spike-Protein zum Hauptziel der durch Impfung-induzierten anti-SARS-CoV-2-Immunität. Das Spike-Protein kann von menschlichen Zellen gebildet werden: (1) bei einer natürlichen Infektion und (2) durch das Einbringen des Bauplans über mRNA- oder DNA-basierte Impfstoffe. Das Persistienz von zirkulierenden SARS-CoV-2-Spike-Proteinen nach Impfung oder Infektion wird als einer von vielen möglichen Pathomechanismen für das Beschwerdebild des Post-COVID- bzw. Post-Vac-Syndroms diskutiert. Die Ursache der Persistenz ist bisher nicht verstanden. Spekuliert wird über ein verbleibendes Virus-Reservoir, RNA-Erhalt oder eine lange Stabilität des Proteins. Klarheit gibt es hier bislang nicht.
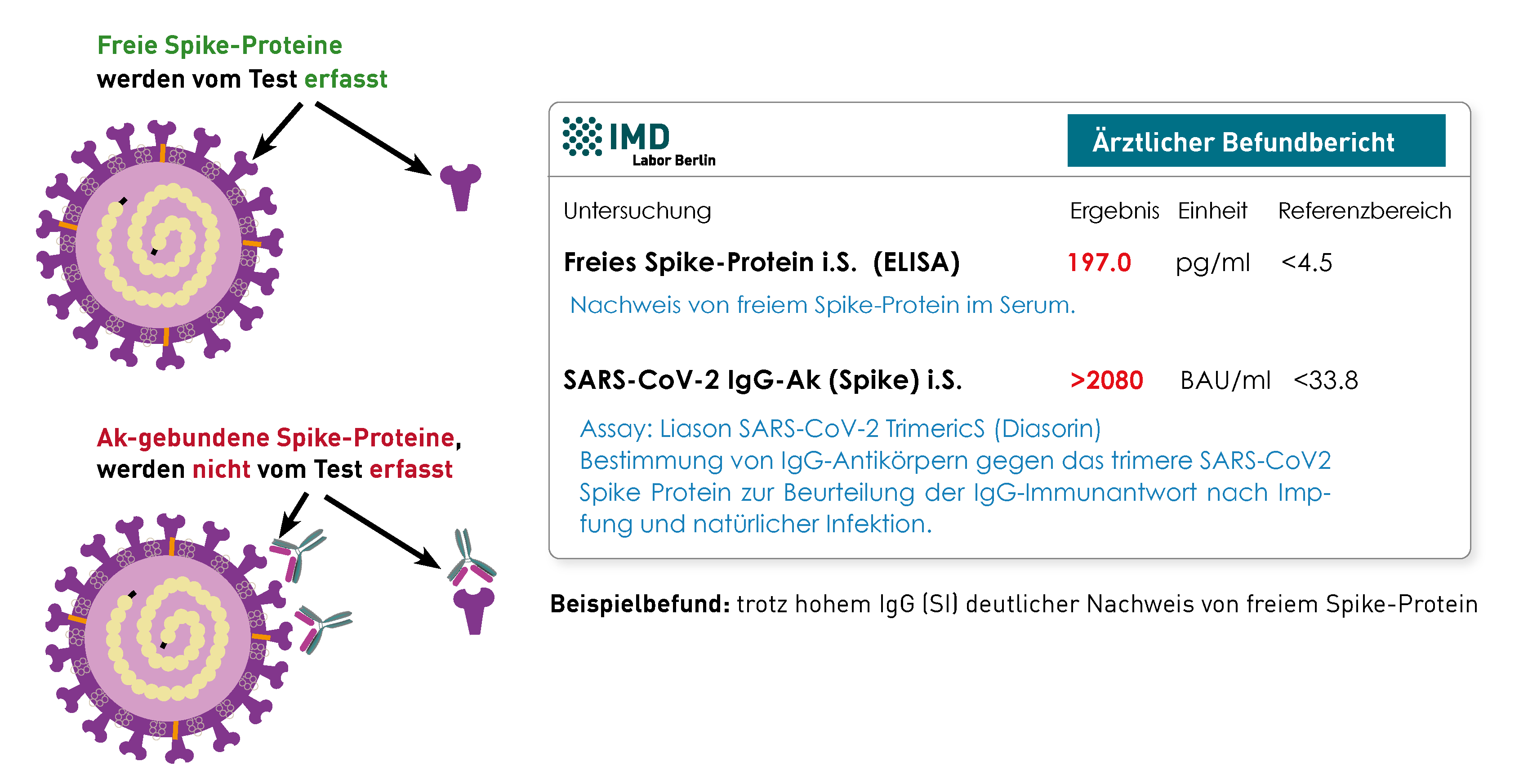
Das im Blut zirkulierende freie Spike-Protein kann mittels ELISA-Technik nachgewiesen werden. Da der Assay das an Antikörper gebundene Spike-Protein nicht erkennt, schließt ein negatives Ergebnis seine Anwesenheit im Patienten nicht zwangsweise aus. Allerdings kann man davon ausgehen, dass gebundenes Spike-Protein nicht an die entsprechenden Ziel-Rezeptoren binden kann und daher keine Wirkung hat. Doch auch hohe S1-IgG-Ak-Titer schließen ein Vorkommen von freiem Spike-Protein nicht aus. Zur Einschätzung der Bindungsfähigkeit der Antikörper kann die Messung der S1-IgG-Ak und ihrer Neutralisationskapazität hilfreich sein.
Derzeit ist es noch nicht möglich, „Impf-Spike-Protein“ von Virus-Spike-Protein zu unterscheiden und somit den Ursprung des persistierenden Proteins zu erfassen, Impfung oder Infektion. Ebenso kann das Spike-Protein bisher nicht den unterschiedlichen SARS-CoV-2-Varianten zugeordnet werden.
Zusammengefasst spricht der Nachweis von freiem Spike für eine Persistenz des Proteins, sofern es nicht während der akuten SARS-CoV-2-Infektion bzw. unmittelbar nach Impfung gemessen wird. Eine Beteiligung des Spike-Proteins an der Pathologie von Post-COVID-bzw. Post-Vac-Syndrom wird angenommen, ist aber bisher nicht bewiesen. Daher ist ein positives Ergebnis immer mit der Klinik (Symptomatik) abzugleichen und letztere ausschlaggebend.
Zur Anforderung dieser Analytik, sowie des IgG (S1) und der Neutralisationskapazität verwenden Sie bitte unseren COVID19-Anforderungsschein (Link zum PDF).
Nein – das ist der Unterschied zum LTT! Der Elispot ist ein sehr gutes und extrem sensitives Laborverfahren, um einen irgendwann stattgefundenen Kontakt zu einem Erreger zu belegen. Deshalb ist er Goldstandard beim Nachweis einer zurückliegenden Tuberkuloseinfektion, unabhängig davon, ob diese aktuell aktiv und behandlungsbedürftig ist oder nicht. Ganz ähnlich wurde auch für Borrelien gezeigt, dass der Elispot nicht zwischen symptomatischen und asymptomatischen Verläufen differenzieren kann. Beide Verfahren wurden in klinischen Studien getestet: Nicht weniger als 10 Publikationen zeigen, dass mit dem LTT eine Differenzierung zwischen aktiver und ausgeheilter Borreliose bzw. Gesunden möglich ist. In 5 der 6 Studien mit Verlaufskontrolle nach Antibiose fiel der LTT nach der Behandlung signifikant ab. Zum Elispot-Test bei Borreliose sind bis heute 9 Patientenstudien publiziert, die im Wesentlichen aussagen, dass der Elispot zwar einen stattgefundenen Kontakt mit Borrelien, d.h. eine Gedächtniszellantwort, mit hoher Sensitivität nachweist, aber keine Differenzierung zwischen aktiver Borreliose und ausgeheilter Erkrankung erlaubt. Da der Elispot häufig auch nach Ausheilung oder antibiotischer Therapie dauerhaft positiv bleibt, dient er im Unterschied zum LTT nicht dazu, die Indikation für eine antibiotische Therapie zu stellen. Einen Überblick über die aktuelle Studienlage zu beiden Tests haben Frau Dr. Hopf-Seidel und Dr. Volker von Baehr kürzlich in der UMG veröffentlicht. Sie finden den Artikel hier.
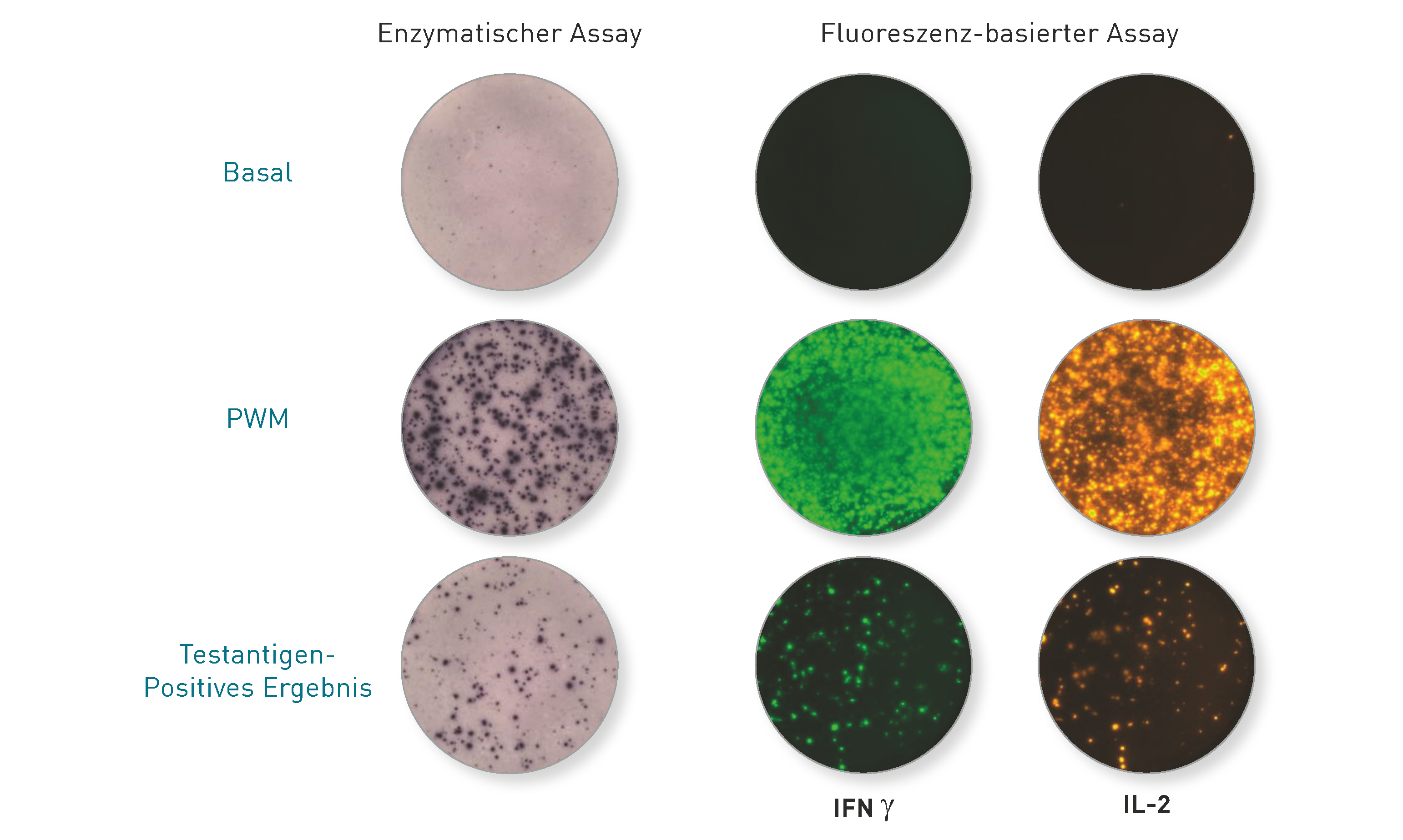
Die Abbildung zeigt die Ergebnisse des Elispot (Enzymatisch und Fluoreszenz-basiert) in der Negativ- und Positivkontrolle (Reihe 1 und 2) und nach Stimulation mit M. tuberkulosis-spezifischen Peptiden (untere Reihe). Hier erkennt man farblich und fluoreszenz-angefärbte Zytokin-positive Gedächtnis-T-Zellen, die eine Immunität widerspiegeln (auch wenn diese bekanntlich bei Borrelien wegen der Diversität der Erregerstämme nicht vor Neuinfektionen schützt).
Auffällige „Leberwerte“, kann es sich um eine Autoimmunerkrankung handeln?
Ja durchaus. Veränderte Leberwerte sollten zügig abgeklärt werden, da sie eine Schädigung der Leberzellen anzeigen. Zu diesen Werten zählen z.B. bestimmte Enzyme, die dann ansteigen, wie GOT, GPT, GGT und AP. Nach Abklärung häufiger Ursachen für eine Leberentzündung, wie z.B. Fettleber (durch Übergewicht, Diabetes mellitus, Alkohol) oder Virusinfektionen, sollte auch an die Eisenspeicherkrankheit Hämochromatose und eben an autoimmune Lebererkrankungen gedacht werden. Autoimmun bedingte Entzündungen der Leber oder Gallengänge sollen lt. der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) bis zu 20% der Fälle ausmachen. Zu den 3 Hauptformen der autoimmunen Lebererkrankungen zählen die Autoimmunhepatitis (AIH), die primär-biliäre Cholangitis (PBC) und die primär-sklerosierende Cholangitis (PCS). Da diese Erkrankungen über lange Zeit symptomlos bleiben oder nur unspezifische Symptome wie z.B. Müdigkeit und Juckreiz zeigen, wird eine Diagnose leider oft erst im fortgeschrittenen Stadium gestellt. Das kann sich allerdings ungünstig auf den Verlauf und die Prognose auswirken. Essentiell für eine Diagnose und Differenzierung ist neben der klinischen Symptomatik die Bestimmung spezifischer Autoantikörper (AAk). Leitliniengerecht sollten neben den quantitativen Immunglobulinen (IgG, IgM, IgA) vor allem folgende AAk untersucht werden: ANA (anti-nukleäre Ak), ASMA (AAk gegen glatte Muskulatur)/Aktin-AAk, LKM-AAk (anti-Leber-Nieren-Mikrosomen-Ak), AMA (anti-Mitochondrien-Ak), SLA/LP-AAk (lösliches Leberantigen-AAk) und pANCA (anti-neutrophile zytoplasmatische Ak). Die entsprechende klinische Zuordnung der AAk sieht folgendermaßen aus:
- AIH wird abhängig vom AAk-Profil in zwei Subformen unterschieden: AIH Typ 1 → ANA, ASMA/Aktin-AAk oder SLA/LP-AAk; AIH Typ 2 → LKM-AAk, LC1-AAk
- PBC: Diagnostisch wegweisend sind AMA (M2-AMA) und bestimmte ANA-Fluoreszenzmuster („mehrere nukleäre Punkte“, „nukleär randständig (Kernmembran)“ oder „Zentromere“)
- PSC: Einen wertvollen Anhaltspunkt liefern die pANCA, es gibt jedoch keine spezifischen serologischen Marker.
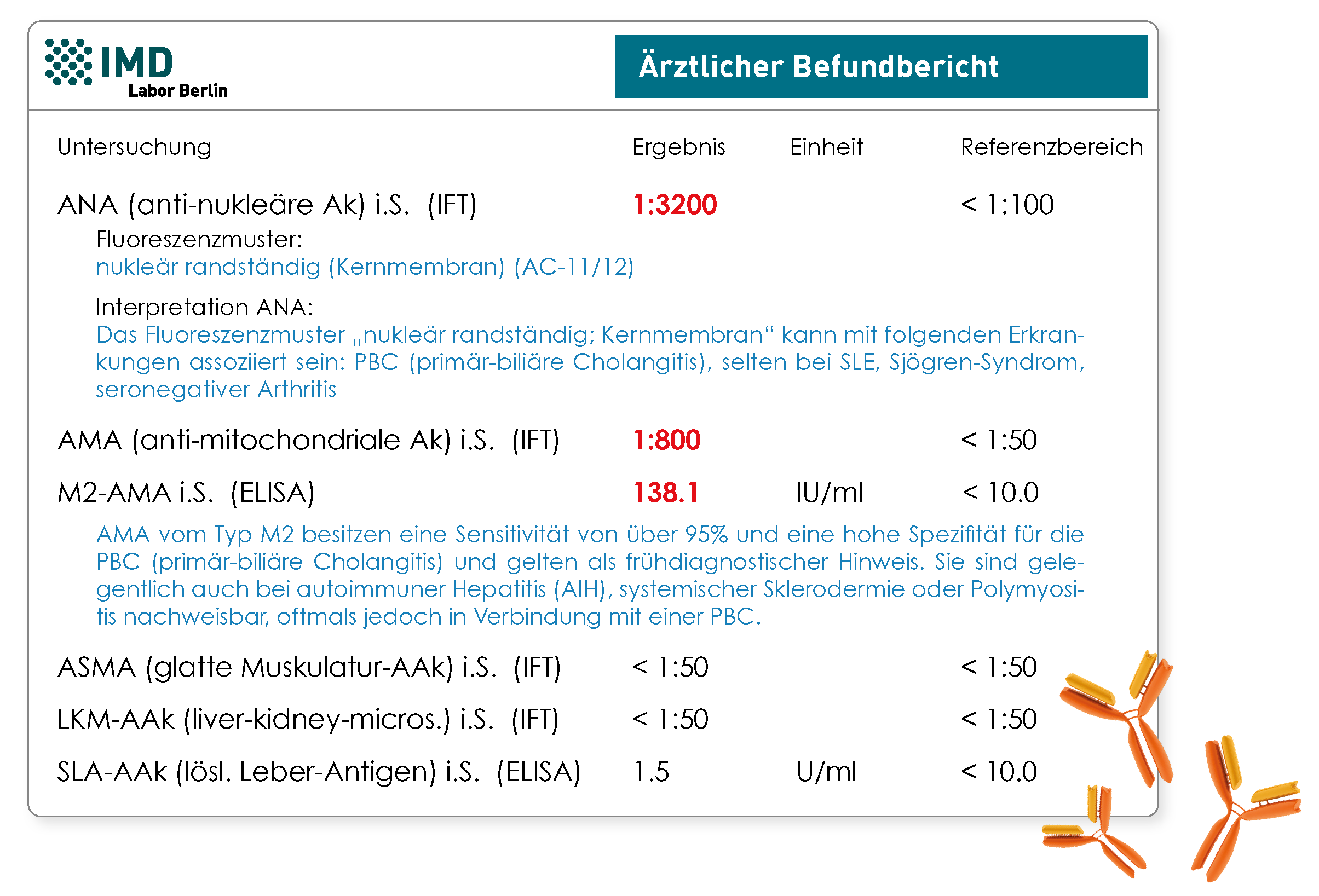
Abb.: Beispielbefund mit serologischem Hinweis auf eine primär-biliäre Cholangitis (PBC)
Nein. Die bei diesem Krankheitsbild auftretenden Autoantikörper (AAk) sind nicht Ausdruck einer organspezifischen pathologischen Immunreaktion, wie z.B. TPO-AAk bei der Hashimoto-Thyreoiditis oder Leber-AAk bei der Autoimmunhepatitis. Vielmehr treten sie – häufig passager – im Rahmen systemischer Entzündung und gestörter Immuntoleranz in Folge der Infektion (oder auch der Impfung) auf. Bei Post-COVID ist bei einem signifikanten Anteil der Patienten eine Persistenz von unterschiedlichen AAk zu beobachten. Gemäß aktueller Empfehlungen sollten symptomorientiert bestimmte Autoimmunerkrankungen ausgeschlossen werden. Das betrifft die Analyse von AAk gegen Zellkernbestandteile (ENA, dsDNA), ACLA, ß2-GPI, MPO, PR3, Tg und TPO. Darüber hinaus empfehlen wir die Untersuchung der Antikörper gegen so genannte G-Protein-gekoppelte Rezeptoren (GPCR). GPCR-AAk wurden mit zahlreichen Erkrankungen des kardiovaskulären, pulmonalen und zentralen Nervensystems sowie mit Autoimmunerkrankungen in Verbindung gebracht und könnten auch bei der Pathogenese der Post-COVID-Symptome kausal von Bedeutung sein.
Richtig ist, dass die Auslösung von Autoimmunität und die Bildung von Autoantikörpern nach einer akuten Virusinfektion zu den führenden Hypothesen der Immun-Pathophysiologie des Post-COVID-Syndroms zählen. Daher haben sie Bedeutung für die Diagnosestellung und Differentialdiagnostik. Da sie aber nicht spezifisch sind, lässt sich dieses Krankheitsbild damit nicht zweifelsfrei beweisen.
Abkürzungen: ENA (extrahierbare nukleäre Antigene), dsDNA (Doppelstrang-DNA), ACLA (Cardipolipine), ß2-GPI (ß2-Glykoprotein I), MPO (Myeloperoxidase), PR3 (Proteinase 3), Tg (Thyreoglobulin), TPO (Thyreoperoxidase), GPCR (G-Protein-gekoppelte Rezeptoren).
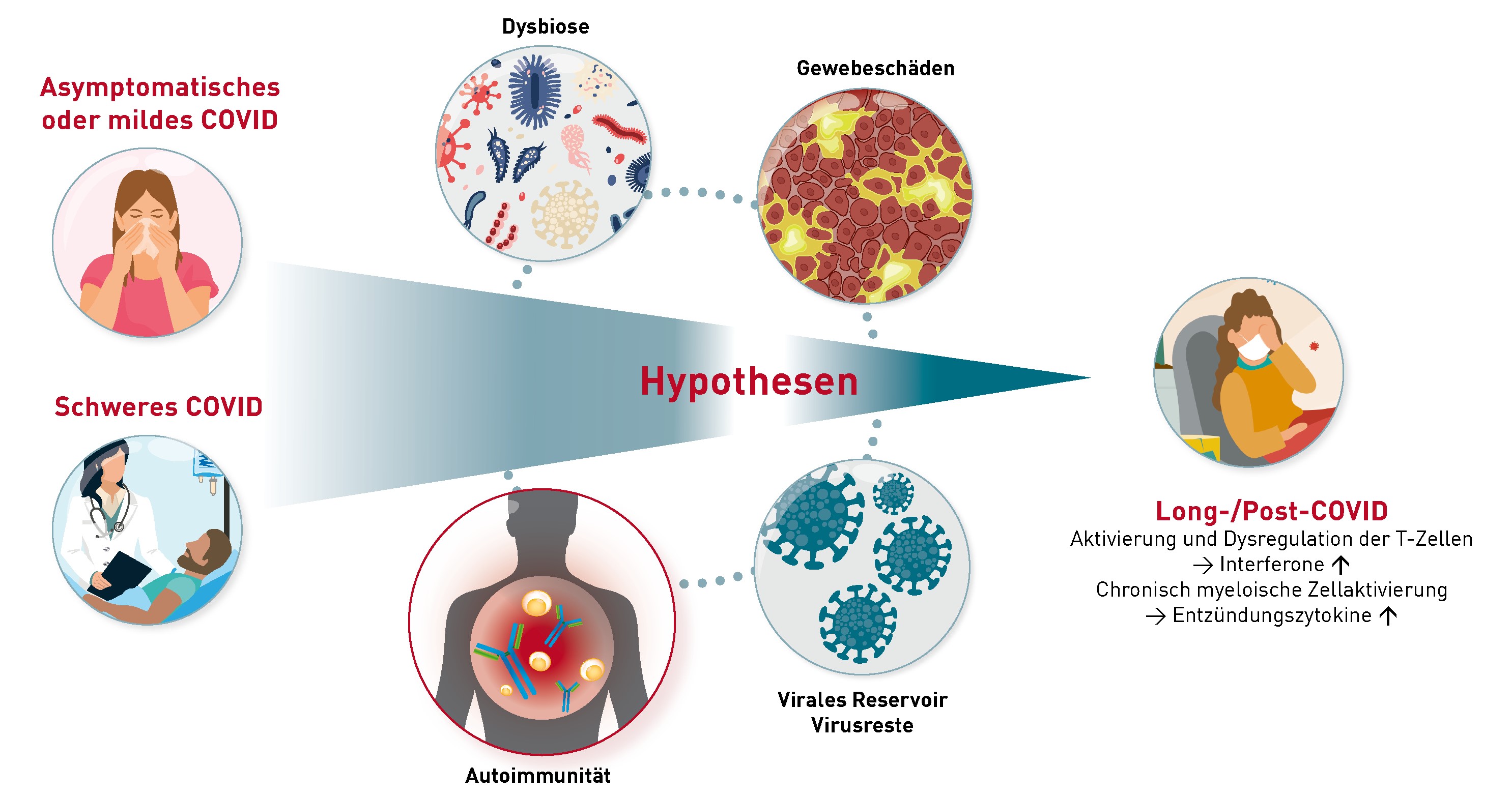
Nein, die Schutzwirkung SARS-CoV-2-spezifischer Antikörper gegenüber Omikron kann nicht durch den herkömmlichen Surrogat-SARS-Neutralisationstest ermittelt werden. Hier ist der neue Omikron-Neutralisationstest weit überlegen. Vor dem Auftreten von Omikron korrelierte die Höhe der IgG (S1)-Titer sehr gut mit der Neutralisationskapazität gegenüber den verschiedenen SARS-CoV2-Varianten. Mit der Ausbreitung von Omikron ergaben sich bald Hinweise, dass die Wirksamkeit der durch die Impfung oder Infektion (nicht Omikron-Variante) gebildeten Antikörper gegenüber der Omikron-Variante deutlich vermindert sei. Aufgrund vieler Mutationen im Omikron-Spikeprotein 1, passen die zuvor generierten IgG (S1)-Antikörper nicht mehr exakt und verlieren dadurch ihre Bindungs- und somit auch ihre Neutralisationsfähigkeit. Bisher verfügbare und zugelassene Tests zur Messung der Neutralisationskapazität bezogen sich ausschließlich auf die Bindungsfähigkeit der Antikörper an die Wildtypvariante (ursprüngliches Virus). Da auch alle bisherigen Impfungen auf dem Spikeprotein der Wildtyp-Viren beruhen, kann hiermit effizient getestet werden, ob sich eine humorale Immunität entwickelt hat. Unsere eigenen Austestungen zeigen allerdings, dass daraus auf die Schutzwirkung gegenüber der vorherrschenden Omikron-Variante kaum Rückschlüsse gezogen werden können (siehe Abbildung). Obwohl jeder Proband der Austestung, entweder geboostert oder genesen, einen IgG (S1)-Wert > 384 BAU/ml aufwies und eine vergleichbare Neutralisationskapazität von >90 % gegenüber der Wildtyp- und Delta-Variante zeigte, variierte die Neutralisationsfähigkeit gegenüber der Omikron-Variante von Proband zu Proband deutlich. Die Höhe des IgG (S1)-Titers korreliert in Bezug auf Omikron nun nicht mehr mit der Wirksamkeit der Antikörper. Seit März kann daher am IMD Berlin die Neutralisationsfähigkeit wahlweise gegenüber der Wildtyp und / oder der Omikron-Variante getestet werden.
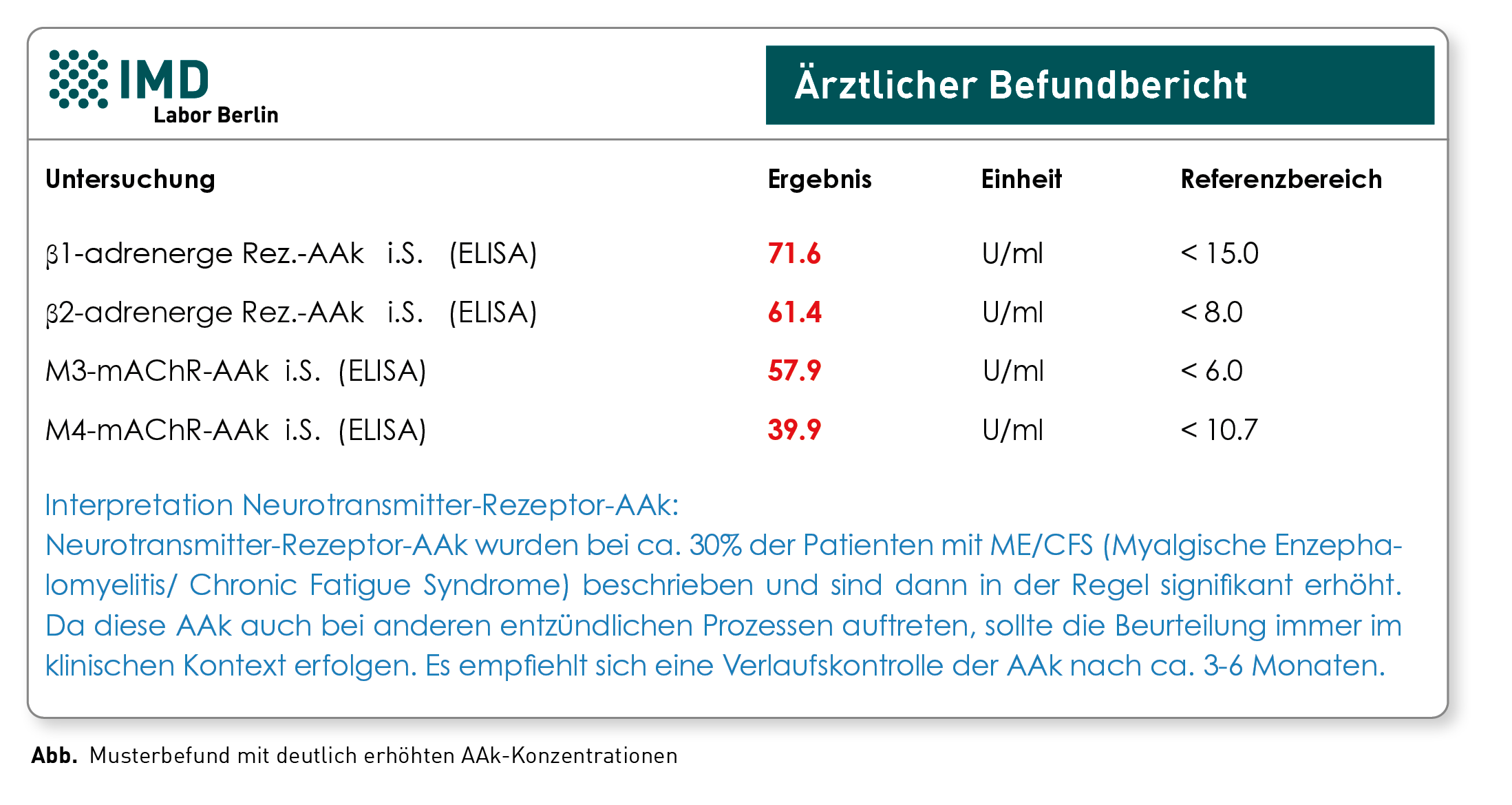
Das Chronische Fatigue Syndrom (CFS), auch Myalgische Enzephalitis (ME) genannt, ist eine sehr schwere Erkrankung, die in ca. 2/3 der Fälle durch eine Infektion ausgelöst wird, beispielsweise nach einer Grippe oder EBV-Infektion. Auch im Zusammenhang mit dem Coronavirus SARS-CoV-2 wurde beobachtet, dass ein Teil der Patienten Wochen bis Monate nach dem Infekt Beschwerden entwickeln, die als „Long-COVID“ oder „Post-COVID-19-Syndrom“ bezeichnet werden und an ME/CFS erinnern. In solchen infektbedingten Fällen ist das CFS/ME höchstwahrscheinlich eine Autoimmunerkrankung, die auch mit dem Auftreten von verschiedensten Autoantikörpern (AAk) assoziiert ist. Eine besondere Rolle spielen dabei u.a. Antikörper, die sich gegen Neurotransmitter-Rezeptoren richten. In einer Studie wurden bei einem Teil der CFS/ME-Patienten erhöhte AAk gegen adrenerge und muskarinerge Acetylcholin-Rezeptoren nachgewiesen. Diese AAk gehören zur Gruppe der sogenannten G-Protein-gekoppelten Rezeptoren (GPCR) und sind Teil eines regulatorischen Netzwerkes, das bei zahlreichen Erkrankungen dysreguliert ist. Sie sind an der Pathogenese verschiedener Autoimmun- und Nicht-Autoimmunerkrankungen beteiligt. Auch wenn die Neurotransmitter-Rezeptor-AAk keine spezifischen Biomarker für das CFS/ME sind, können sie unterstützend zur Diagnosestellung von ME/CFS herangezogen werden. Aktuell haben positive Neurotransmitter-Rezeptor-AAk-Befunde keine direkte therapeutische Relevanz. Detaillierte Hintergründe finden Sie in unserer aktualisierten Diagnostik-Information.
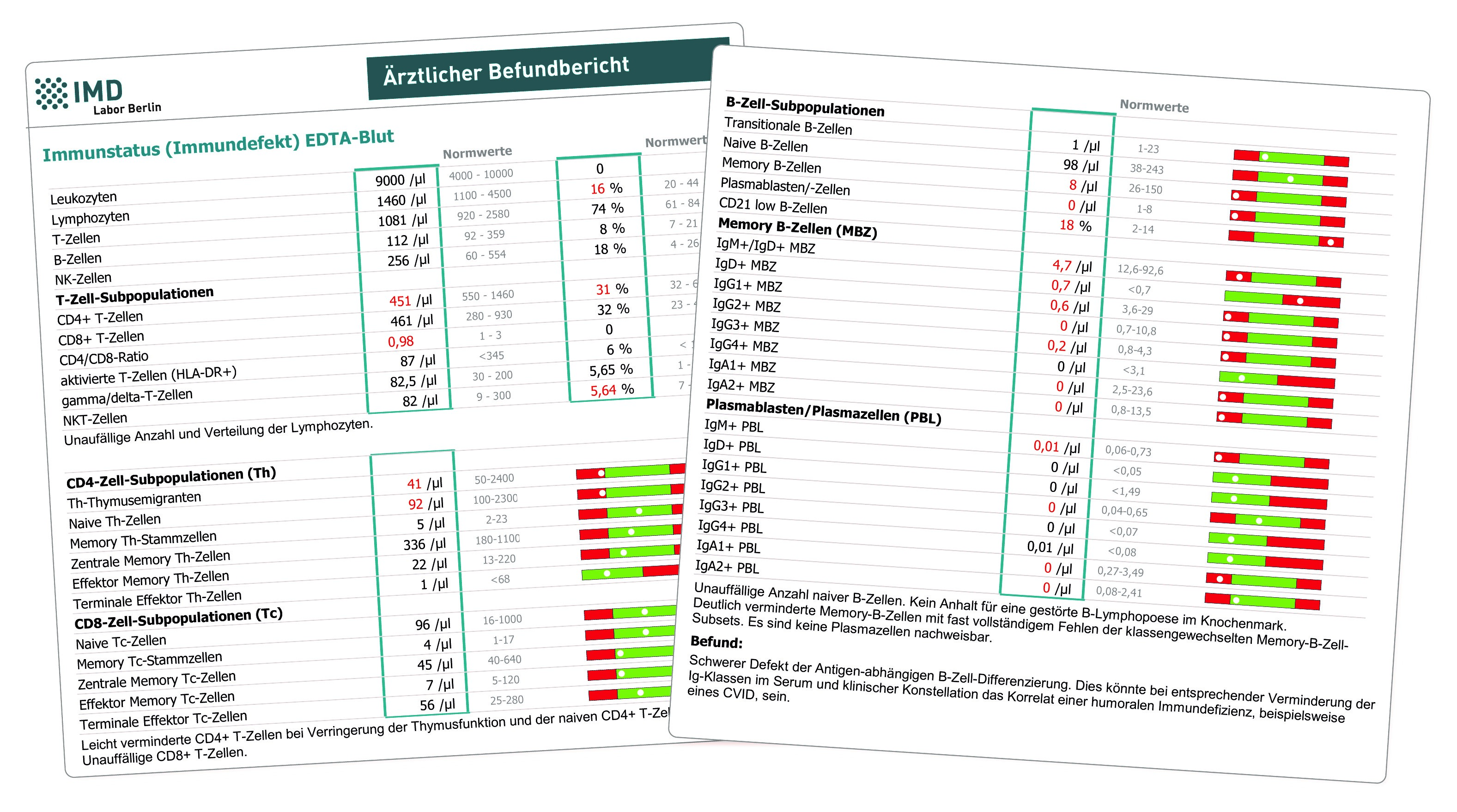
Diese Untersuchung wurde durch unser Labor für die Diagnostik von angeborenen Immundefekten entwickelt. Entgegen der weit verbreiteten Meinung, dass diese Erkrankungen nur im Kindesalter auftreten und mit einer schweren Infektanfälligkeit einhergehen, werden 50 % der Diagnosen erst bei Erwachsenen gestellt. Dies liegt unter anderem daran, dass unter Umständen klinisch die Infektanfälligkeit nicht im Vordergrund steht, sondern andere Symptome wie Autoimmunität, unklare Entzündungen oder Fatigue dominieren. Die häufigste Diagnose bei diesen Patienten sind Störungen des B-Zell-Systems, die mit einem Antikörpermangel einhergehen.
Im „zellulären Immunstatus Immundefekt“ wird dementsprechend eine umfassende Analyse derjenigen Immunzellen vorgenommen, die an Antikörperantworten beteiligt sind (T- und B-Lymphozyten). Hierbei werden Anzahl und Entwicklungsstufen dieser Zellen quantifiziert und damit Bildung und aktivierungsbedingte Differenzierung der Lymphozyten nach Kontakt mit Antigenen überprüft. Darüber hinaus erfolgt eine Analyse der IgG- und IgA-Subklassen-Produktion durch die B-Lymphozyten, so dass das zelluläre Korrelat eines IgG-Subklassen- oder IgA-Mangels nachgewiesen werden kann.
Eingesetzt werden sollte der zelluläre Immunstatus „Immundefekt“ daher zur weiteren Abklärung bei Patienten mit Infektanfälligkeit, insbesondere dann, wenn ein Immunglobulinmangel oder ein Subklassendefekt bereits nachgewiesen wurde. Eine Bestimmung der Immunglobuline (IgA, IgG und IgM) sollte spätestens zeitgleich zum Immunstatus erfolgen, da ansonsten nur eine eingeschränkte Beurteilung erfolgen kann.
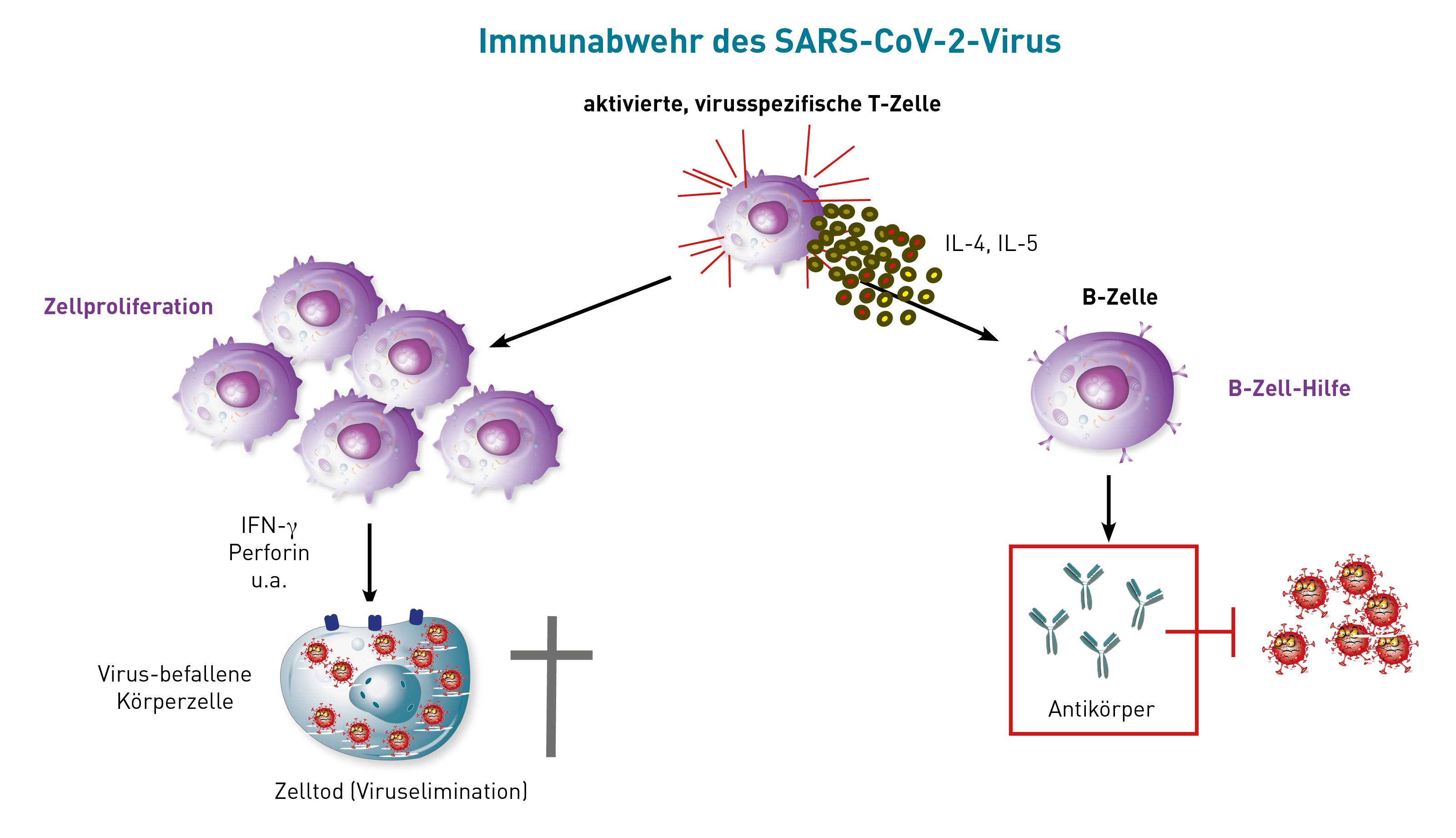
Die Impfung, wie auch die natürliche Infektion, induziert sowohl eine Antikörperantwort (humorale Immunität) als auch SARS-CoV-2-spezifische T-Gedächtniszellen (zelluläre Immunität). Zu deren Nachweis kommen für die humorale Immunität der SARS-CoV-2-IgG-Titer gegen das Spike-Protein (S1) und neuerdings auch der Surrogat-Virus-Neutralisationstest (sVNT), sowie für die zelluläre Immunität der LTT-SARS-CoV-2 in Frage.
Trotz guter Korrelation zwischen dem SARS-CoV-2-IgG(S1)-Titer und der Neutralisationskapazität im sVNT kann der letztgenannte Test aber dennoch, vor allem bei einem niedrigeren IgG-Titer unter 150 BAU/ml, sowie in Grenzbereichen mehr Klarheit schaffen über die tatsächlich schützenden funktionellen Eigenschaften der vorhandenen SARS-CoV-2-IgG (S1)-Antikörper. Andere Antikörper wie SARS-IgG(Nc), -IgA oder -IgM sowie Global- oder Antikörperschnelltests sind lediglich für die Infektionsdiagnostik von Bedeutung, sind aber kein Gradmesser eines immunologischen Schutzes.
Für den Nachweis SARS-CoV-2-spezifischer-T-Gedächtniszellen gibt es sowohl den LTT auf die SARS-CoV-2-Peptide des Spike-Proteins (gemessen wird die Proliferation der Zellen), als auch den Elispot, der die Botenstoffe der T-Zellen misst. Zumindest bei unseren vergleichenden Analysen zeigte der LTT im Vergleich zum Elispot die höhere Sensitivität und Spezifität.
Zu beachten ist, dass die STIKO derzeit eine Laborkontrolle des Impferfolges (noch) nicht empfiehlt. Zum einen hätte eine zu geringe Immunreaktion derzeit auf Grund mangelnder Impfstoffressourcen keine Konsequenz (keine unmittelbare Nachimpfung vorgesehen), zum anderen gibt es aktuell bei keinem der drei Tests definierte Entscheidungsgrenzen, ab wann ein Schutz besteht und wie lange dieser anhält. Das ist auch korrekt. Hier muss man Langzeitstudien abwarten, die heute noch gar nicht vorliegen können. Allerdings können die Resultate der drei genannten Testverfahren auf Grund sehr hoher Spezifität zumindest für jeden persönlich die Aussage treffen, ob das Immunsystem reagiert hat. Ob immunologische Befunde zukünftig eine rechtliche Konsequenz im Sinne eines Immunitätsnachweises haben werden, ist bisher nicht festgelegt. Aktuell trifft das nicht zu. 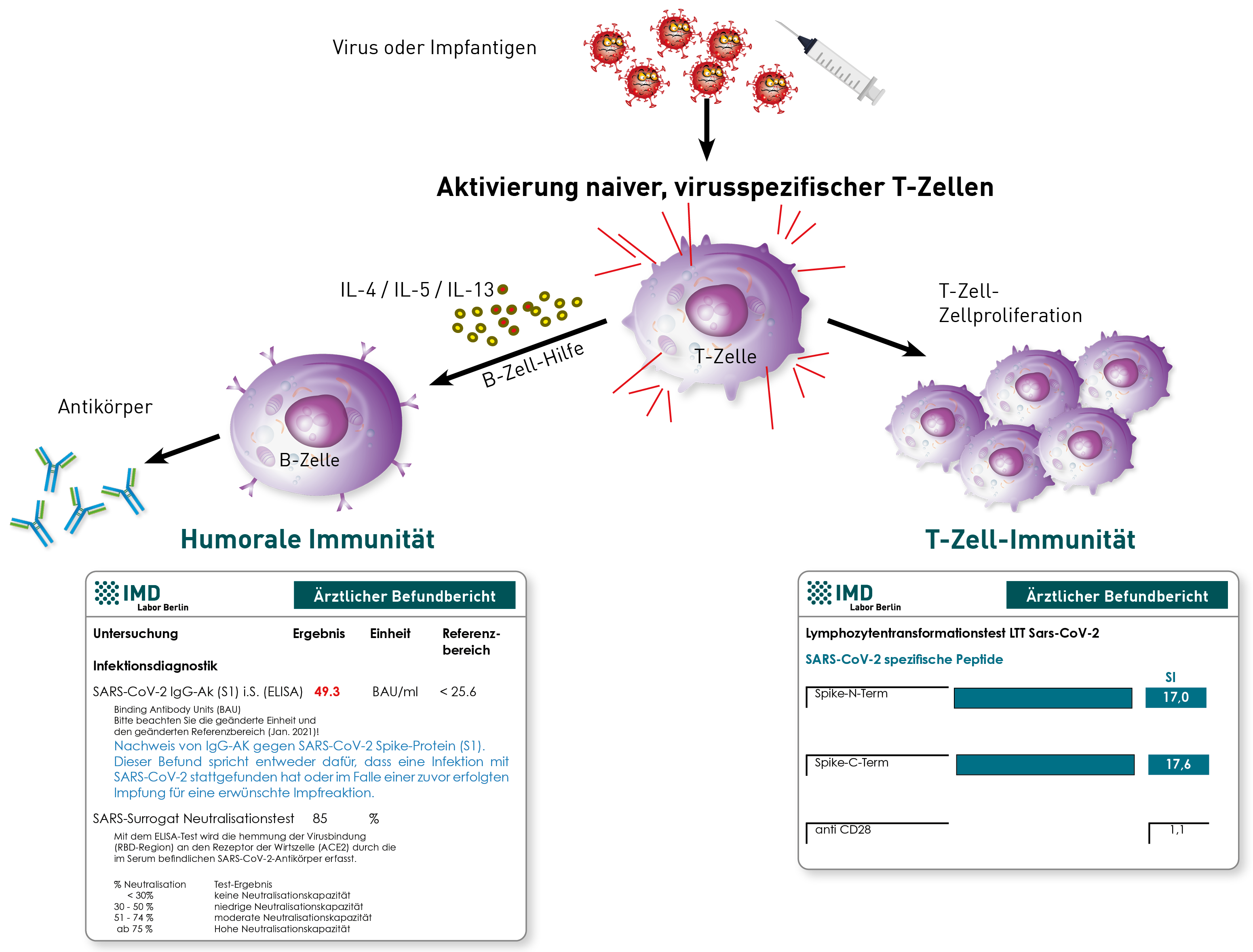
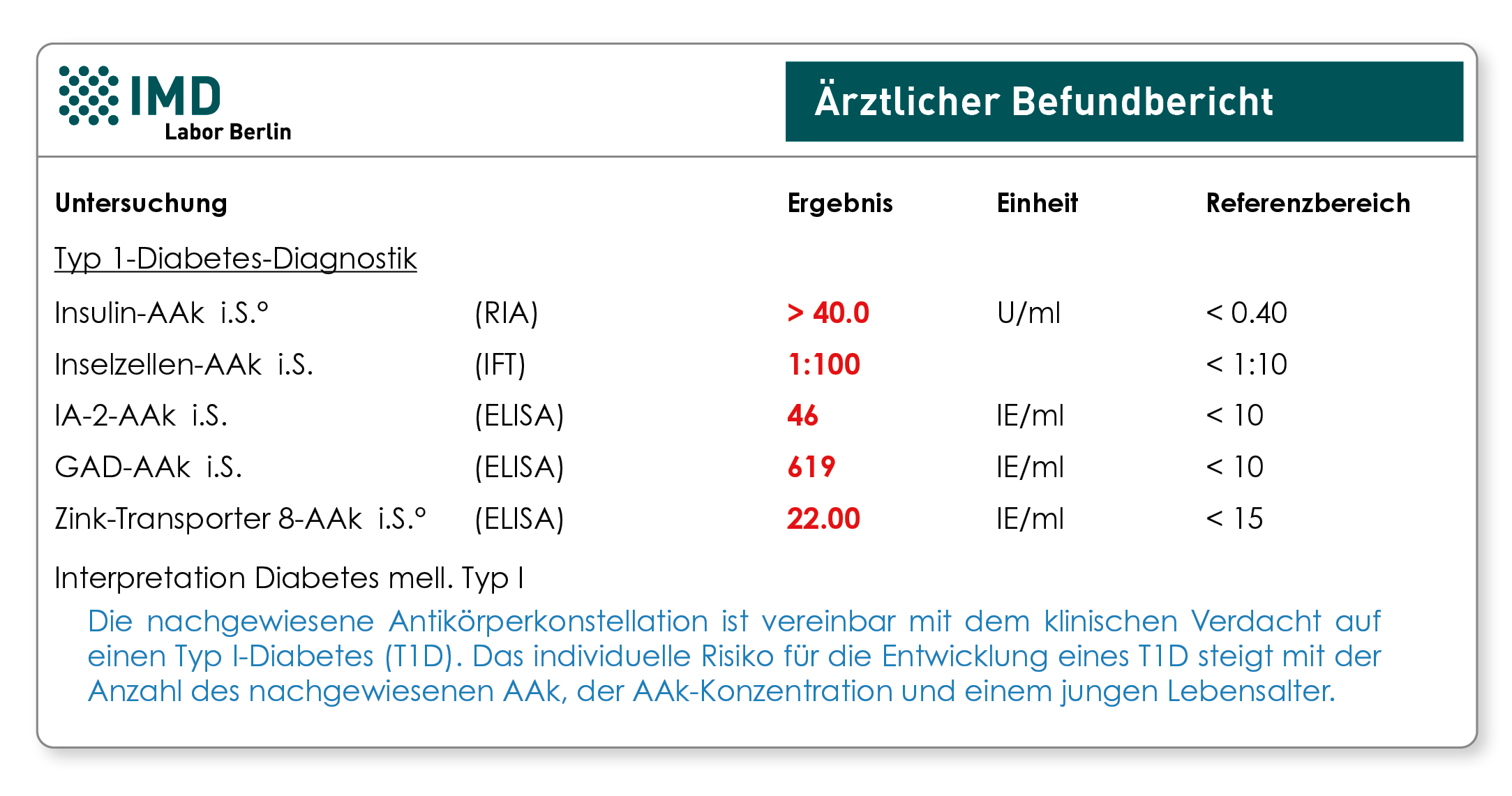
Obwohl wesentlich seltener als der Typ-2-Diabetes, kann der so genannte juvenile Diabetes auch erst im Erwachsenenalter auftreten. Er wird dann als LADA bezeichnet (Latent Autoimmune Diabetes of Adults) und ist für ca. 5-10% aller Diabetesfälle bei Erwachsenen ursächlich. Der LADA beginnt in der Regel abrupt (Tage bis Wochen) mit plötzlich einsetzenden Beschwerden und führt meist nicht sofort zur Insulinpflichtigkeit, weil die Bauchspeicheldrüse noch eingeschränkt Insulin herstellt. Dies erschwert die Abgrenzung zu dem im Erwachsenenalter typischen Typ-2-Diabetes, da die Betroffenen zunächst noch kein Insulin benötigen und auch primär adipös sein können. Die betroffenen Patienten sprechen häufig bereits nach wenigen Monaten nicht mehr auf eine Therapie mit Diät und Antidiabetika an, und eine Insulinbehandlung wird erforderlich. Allein die Bestimmung von Autoantikörpern (AAk) erlaubt sowohl die Differentialdiagnose zwischen Typ 1- und nicht-autoimmunen Diabetesformen, als auch das frühzeitige Erkennen einer Erstmanifestation, die häufig mit einer schweren Stoffwechselentgleisung einhergeht. Die aktuelle Leitlinie (S3-Leitlinie der DDG und AGPD; 2015) empfiehlt die Bestimmung der AAk gegen Insulin, Inselzellen, Glutamat-Decarboxylase (GAD), Tyrosinphosphatase (IA-2) und Zinktransporter 8 (ZnT8).
Bei Anforderung von antinukleären Antikörpern (ANA) wird als Goldstandard immer die indirekte Immun-fluoreszenz (IFT) empfohlen. Der Vorteil besteht darin, dass in einem einzigen Analyseansatz das gesamte Antigenspektrum der ANA erfasst wird. Je nach Antigenlokalisation ergibt sich für jeden ANA ein charakteristisches Fluoreszenzmuster, das zusätzlich zum ANA-Titer im Befund angegeben wird. Positive ANA sollten immer, je nach diagnostischer Fragestellung und Fluoreszenzmuster, durch eine gezielte Differenzierung spezifiziert werden (z.B. dsDNA-AAk-ELISA, ENA-AAk-Blot.
Allerdings ist es bekannt, dass ANA, die sich gegen das Antigen SS-A(Ro) richten, im Immunfluoreszenztest nicht immer erfasst werden, d.h. negative ANA schließen das Vorhandensein von SS-A(Ro)-Antikörpern nicht sicher aus! In der Literatur wird die Häufigkeit mit 2 % angegeben. Bei dem in unserem spezialisierten Labor untersuchten Patientenkollektiv nehmen wir sogar einen höheren prozentualen Anteil an.
SS-A(Ro)-Antikörper werden vorwiegend bei Kollagenosen, vor allem beim Sjögren-Syndrom und verschiedenen Lupus erythematodes-Formen gefunden. Sie können auch schon Jahre vor der klinischen Manifestation nachweisbar sein und sichern eine rechtzeitige Diagnose.
Als Konsequenz dieser diagnostischen Lücke wird bei einem negativen ANA in der Immunfluoreszenz (IFT) die Bestimmung der SS-A(Ro)-AAk angeschlossen, um mit hundertprozentiger Sicherheit einen negativen ANA bewerten zu können.

Die wahrscheinlichste Ursache ist, dass in diesem Fall die IgG-Antikörpertestung 4 Wochen nach dem PCR-Nachweis noch zu früh stattgefunden hat. Zwar zeigen Studien, dass ca. 95% der Patienten drei Wochen nach Auftreten der ersten Symptome IgG-Antikörper haben, aber in diese Studien gingen immer Patienten mit schweren Krankheitsverläufen ein. Patienten mit leichteren oder gar fehlenden Symptomen (positiv abgestrichene Kontaktpersonen) zeigen bekanntermaßen eine verzögerte Antikörperbildung, häufig längere Zeit auch nur IgA-Antikörper und erst nach 5-6 Wochen den Wechsel zu IgG. Deshalb empfehlen wir immer die Kombination IgG und IgA.
Andererseits ist es in seltenen Fällen möglich, dass eine verzögerte oder gar fehlende Antikörperbildung durch einen Immundefekt bedingt ist. Das betrifft alle Viren, nicht nur SARS-CoV-2. Während primäre Immundefekte im Erwachsenenalter als Ursache nahezu auszuschließen sind, kommen sekundäre Antikörpermangelsyndrome häufiger vor und werden oft erst bei anlassbezogener spezifischer Diagnostik erkannt. Zu denken ist an hämatologische Grunderkrankungen (Verdrängung im Knochenmark durch pathologische Klone oder Störung der Hämatopoese), Morbus Cushing, Diabetes mellitus, Hypothyreose, bakterielle Infektionen, Z.n. Strahlen- oder Zytostatikatherapie, immunsuppressive Therapien).
Aber auch ein fehlender Antikörpertiter bedeutet nicht, dass keine Immunität (Infektionsschutz) bestehen kann. Die Immunität gegen Viren, und hier macht das Corona-Virus keine Ausnahme, wird zum großen Teil durch die T-Lymphozyten vermittelt, v.a. durch zytotoxische T-Zellen. Die Antikörper tragen zwar zur Virusabwehr bei, z. B. hemmen neutralisierende Antikörper den Eintritt des Virus in menschliche Epithelzellen, sie sind aber v. a. auch Epiphänomen, dass sich die T-zelluläre Immunabwehr ausgebildet haben muss (denn ohne T-Helferzellen keine Antikörperbildung).
Ja. Die aktuellen Klassifikationskriterien der rheumatoiden Arthritis beruhen auf einem Punktesystem, in dem neben klinischen Symptomen auch Laborparameter berücksichtigt werden. So gehen Entzündungsparameter (erhöhte Blut-körperchensenkungsgeschwindigkeit oder erhöhtes CRP) mit einem Punkt in den Klassifikationsscore ein. Die krankheitsassoziierten Antikörper Rheumafaktor und anti-CCP werden bei einer moderaten Erhöhung (unterhalb des Dreifachen der oberen Referenzbereichsgrenze) mit 2 und bei einer starken Erhöhung (mindestens dreifach über der oberen Referenzbereichsgrenze) mit 3 Punkten bewertet. Hierbei ist es nicht erforderlich, dass beide Marker erhöht sind, für die Klassifikation reicht bereits die Erhöhung eines der beiden Marker. Oft verhalten sich die Marker bei Patienten unterschiedlich, also Rheumafaktor erhöht und CCP normal oder umgekehrt. Mit der Bestimmung von nur einem der beiden Marker kann daher eine RA nicht sicher ausgeschlossen werden.

Abb.: Das Befundbeispiel zeigt einen Patienten mit fehlendem Nachweis von Rheumafaktoren, aber einem deutlich erhöhten anti-CCP-Wert. Dieser liegt dreifach über der oberen Grenze des Referenzwertes und geht daher mit 3 Punkten in den Klassifikationsscore der rheumatoiden Arthritis ein
Nein, als globaler „Einstiegstest für Autoimmunerkrankungen“ ist der ANA-Nachweis nicht geeignet. ANA weisen eine hohe Sensitivität für systemische rheumatische Erkrankungen (Kollagenosen) auf und gelten als Diagnosekriterium für Kollagenosen, nicht jedoch für andere Autoimmunerkrankungen. Zudem finden sich ANA auch bei zahlreichen anderen entzündlichen Prozessen, Tumoren sowie passager im Rahmen von Infektionserkrankungen. Sogar bei Gesunden sind ANA gelegentlich nachweisbar, wenn auch mit niedrigem Titer, mit steigender Prävalenz im Alter > 60 Jahre. Bei Verdacht auf eine Kollagenose kann die Krankheitsspezifität erst durch die ANA-Differenzierung ermittelt werden, wie z. B. Autoantikörper gegen SS-A(Ro) und SS-B(La) bei Sjögren-Syndrom (siehe Befundbeispiel). Bei Verdacht auf andere systemische oder organspezifische Autoimmunerkrankungen, wie z. B. rheumatoide Arthritis, Schilddrüsenerkrankung, Diabetes mellitus Typ 1 oder Zöliakie, sollten daher die entsprechenden diagnostisch relevanten Autoantikörper bestimmt werden (siehe Anforderungsschein „Spezielle Immundiagnostik“ Analysen 281-342). Die zusätzliche Bestimmung der ANA ist zur Differentialdiagnostik durchaus empfohlen, da die Kollagenosen mit verschiedenen Organmanifestationen einhergehen können.

Ja, im Rahmen des Immunmonitorings kann durch Messung von TGF-β im Serum in Kombination mit der Quantifizierung der regulatorischen T-Zellen (Treg) im Blut darauf geschlossen werden, ob durch die Therapie die Effektorzellantwort der T-Lymphozyten tatsächlich gestärkt wird (Abfall von TGF-β- und/oder der Treg-Zellen im Verlauf) oder ob der Therapieeffekt „stagniert“.
Im letztgenannten Fall d. h. bei Anstieg von TGF-β und der Zahl der Treg-Zellen ist eine Modifikation der immunstimulierenden Therapie anzuraten (Präparatewechsel). Die gute Aussagekraft von TGF-β leitet sich daraus ab, dass dieses Zytokin ein wichtiges Effektorzellzytokin der Treg-Zellen ist.
Im Gegensatz zu IL-10, (welches von Treg, TH2-Lymphozyten und Monozyten sezerniert wird) wird TGF-β von anderen Blutzellen allenfalls in sehr geringen Mengen freigesetzt.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 239, 276
FAQ Kategorien
