Häufig gestellte Fragen (FAQ)
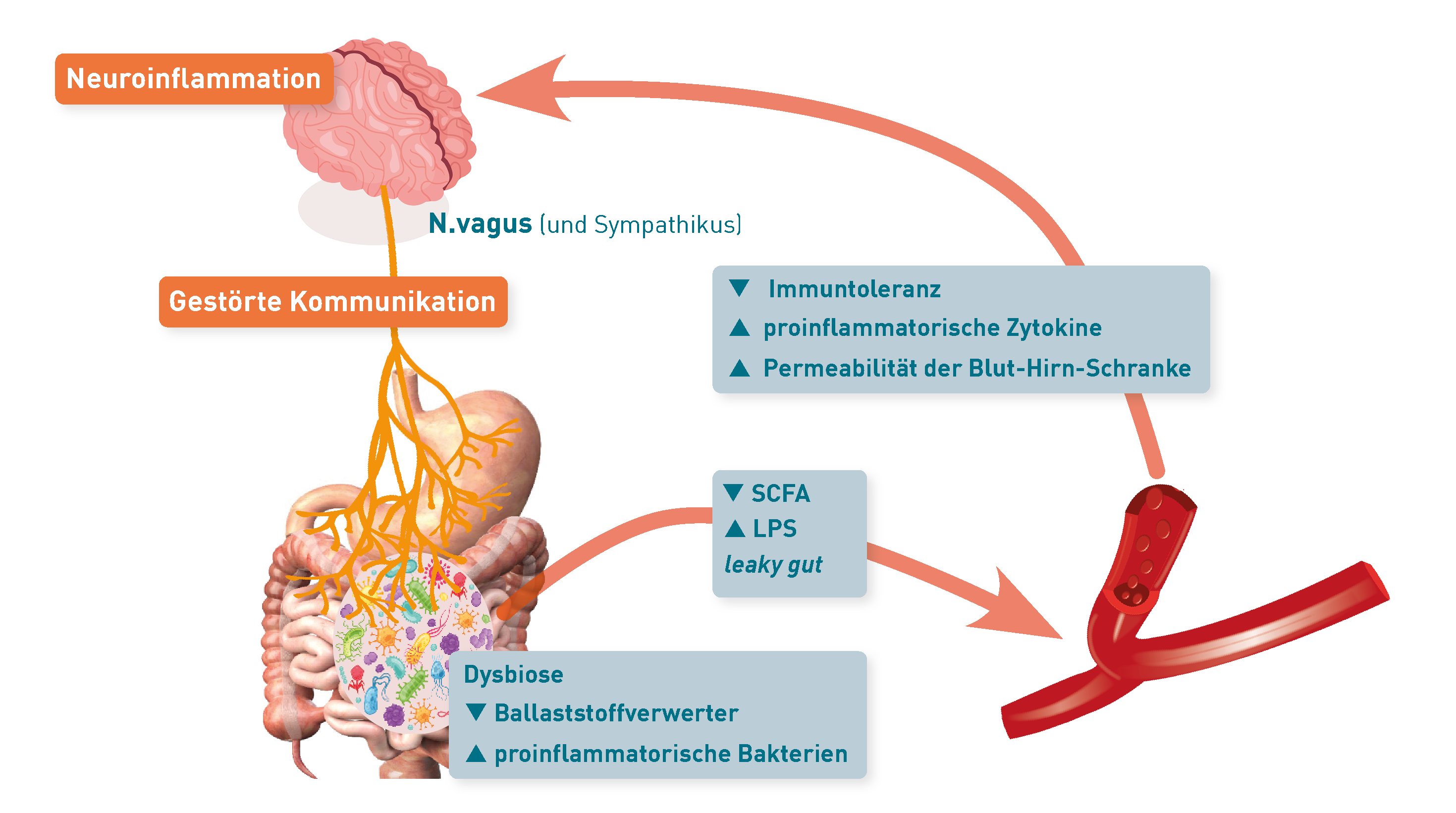
Nervensystem
Nach aktuellem Stand der Forschung ist die Antwort „Ja“, denn Darmbakterien beeinflussen direkt die Ausschüttung von Signalmolekülen, die über die Darm-Hirn-Achse mit dem zentralen Nervensystem kommunizieren. Dies geschieht z.B. über Lipopolysaccharide aus der Zellwand der Proteobacteria, die proinflammatorische Zytokine induzieren, und über neuroaktive bakterielle Stoffwechselprodukte wie kurzkettige Fettsäuren (SCFA), Metabolite des Tryptophanstoffwechsels oder sekundäre Gallensäuren. Studien belegen, dass Veränderungen der bakteriellen Zusammensetzung im Darm (Dysbiose) die Wechselwirkungen mit dem ZNS stören und Gehirnfunktionen und Verhaltensweisen, einschließlich Stimmung, Gedächtnis und Schmerzempfinden, beeinflussen. Eine Dysbiose kann außerdem Entzündungen der Darmschleimhaut und eine erhöhte Permeabilität der Darmbarriere verursachen. Dadurch gelangen u.a. bakterielle Bestandteile und Stoffwechselprodukte vermehrt in den systemischen Kreislauf und können eine dauerhafte Aktivierung des Immunsystems und systemische Entzündungsreaktionen auslösen oder verstärken. Die Modulation der Darmmikrobiota und ihrer Metabolite rückt daher als vielversprechender Ansatz zur Beeinflussung neuroimmunologischer Erkrankungen (z.B. der multiplen Sklerose) in den Fokus. Eine gesunde Ernährung, Prä- und Probiotika können dazu beitragen, die Balance der Darmmikrobiota und der Immunregulation aufrechtzuerhalten. Um den aktuellen Zustand des Darmmikrobioms, der Darmschleimhaut und ihrer Barrierefunktion zu beurteilen, liefern Mikrobiomanalysen, Stuhlparameter für Entzündung und leaky gut (Calprotectin, Alpha-1-Antitrypsin, Zonulin) sowie die kurzkettigen Fettsäuren in Stuhl und Serum wichtige Hinweise (siehe Anforderungsschein Mikrobiomdiagnostik, Link zum PDF).
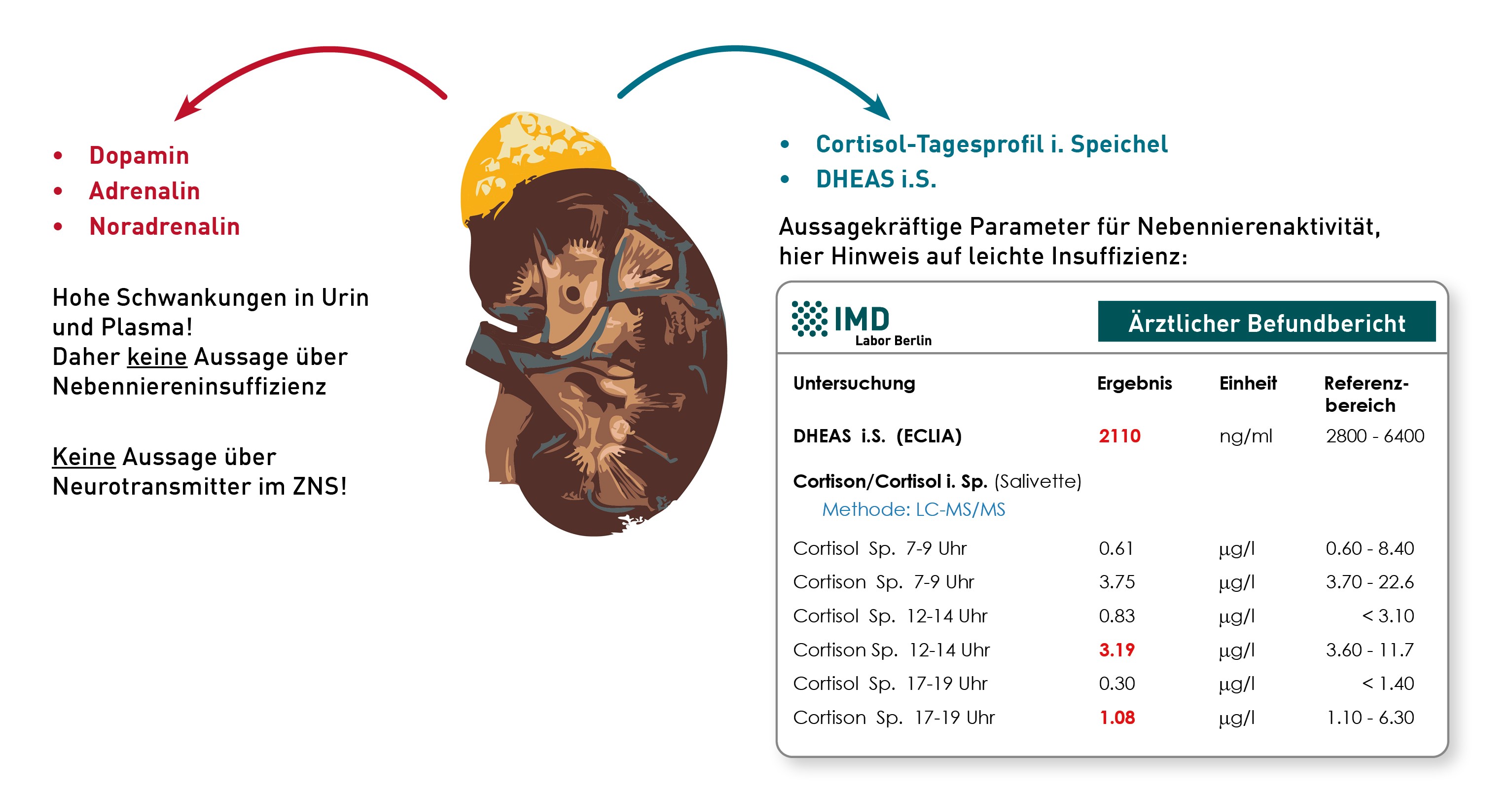
Der Begriff „Neurostress“ bezieht sich populärwissenschaftlich auf eine verminderte Produktion von Stresshormonen in den Nebennieren und damit auf Zustände einer leichten Nebenniereninsuffizienz, die von einem Morbus Addison abgegrenzt werden kann. Aussagekräftige Laborparameter stellen das „Cortisol-Tagesprofil im Speichel“ und der Sexualhormon-Vorläufer „DHEAS im Serum“ dar:
• Charakteristisch ist eine Abflachung des Cortisol-Tagesprofil auf niedrigem Niveau, entsprechend einer wenig ausgeprägten zirkadianen Rhythmik des Stresshormons Cortisol. Die abgeflachte Kurve geht häufig mit Müdigkeit und Antriebslosigkeit einher.
• DHEAS wird wie Cortisol in der Nebennierenrinde gebildet und ist Vorläufer für Steroidhormone. Auch eine reduzierte Synthese der Sexualhormone kann Erschöpfungssymptomen zugrunde liegen.
Wenig aussagekräftig ist hingegen die Messung von Katecholaminen (Adrenalin, Noradrenalin, Dopamin) im Urin oder Plasma – insbesondere deshalb, weil die Konzentrationen von Stresshormonen hohen interindividuellen Schwankungen unterliegen, die eine Insuffizienz vortäuschen bzw. kaschieren können. Entsprechung wird auch bei Cortisol nicht die einzelne Konzentration, sondern die Veränderung im Tagesverlauf beurteilt. Klar ist, dass die von der Nebenniere ausgeschütteten Katecholamine als Stresshormone fungieren und allenfalls mit der individuellen Sympathikus-Aktivierung korrelieren. Sie liefern hingegen keinerlei Aussagen über den Neurotransmitterhaushalt im peripheren oder gar zentralen Nervensystem. Die eng regulierte, präzische Ausschüttung winziger Mengen von Neurotransmittern an den Synapsen kann über Untersuchungen von Blut oder Urin nicht erfasst werden. Es ist lediglich möglich, im Blut den Versorgungsstatus mit Ausgangssubstanzen und Kofaktoren der Neurotransmittersynthesen zu analysieren (u.a. Tryptophan, Tyrosin, Phenylalanin, Vitamin B6, B12, Magnesium). Ein Rückschluss auf „Neurostress“ innerhalb des ZNS im Sinne einer Fehlregulation auf immunologische und endokrine systemische Reize ist über Labordiagnostik nicht möglich, weder aus Urin, Blut und Speichel.
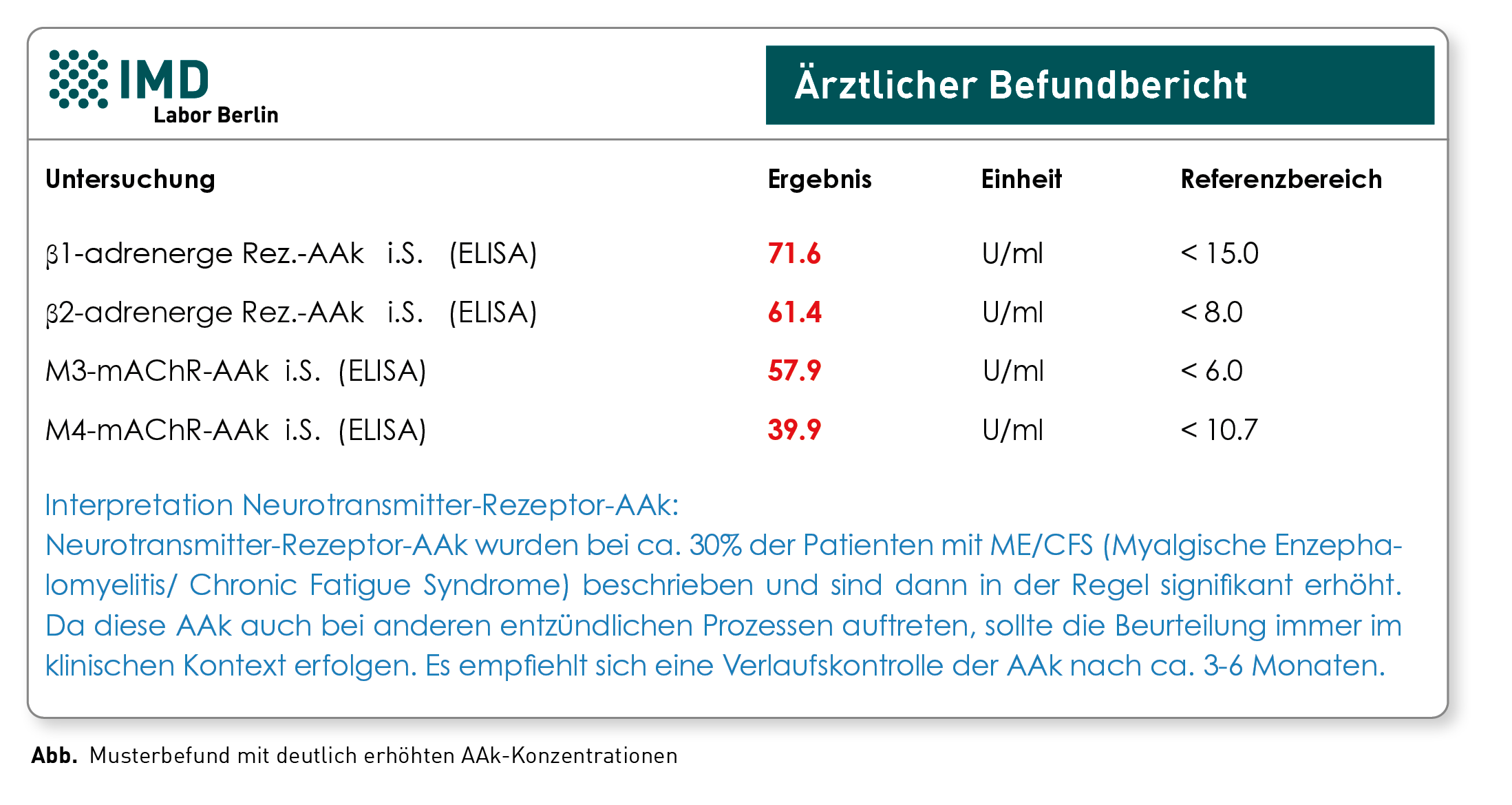
Das Chronische Fatigue Syndrom (CFS), auch Myalgische Enzephalitis (ME) genannt, ist eine sehr schwere Erkrankung, die in ca. 2/3 der Fälle durch eine Infektion ausgelöst wird, beispielsweise nach einer Grippe oder EBV-Infektion. Auch im Zusammenhang mit dem Coronavirus SARS-CoV-2 wurde beobachtet, dass ein Teil der Patienten Wochen bis Monate nach dem Infekt Beschwerden entwickeln, die als „Long-COVID“ oder „Post-COVID-19-Syndrom“ bezeichnet werden und an ME/CFS erinnern. In solchen infektbedingten Fällen ist das CFS/ME höchstwahrscheinlich eine Autoimmunerkrankung, die auch mit dem Auftreten von verschiedensten Autoantikörpern (AAk) assoziiert ist. Eine besondere Rolle spielen dabei u.a. Antikörper, die sich gegen Neurotransmitter-Rezeptoren richten. In einer Studie wurden bei einem Teil der CFS/ME-Patienten erhöhte AAk gegen adrenerge und muskarinerge Acetylcholin-Rezeptoren nachgewiesen. Diese AAk gehören zur Gruppe der sogenannten G-Protein-gekoppelten Rezeptoren (GPCR) und sind Teil eines regulatorischen Netzwerkes, das bei zahlreichen Erkrankungen dysreguliert ist. Sie sind an der Pathogenese verschiedener Autoimmun- und Nicht-Autoimmunerkrankungen beteiligt. Auch wenn die Neurotransmitter-Rezeptor-AAk keine spezifischen Biomarker für das CFS/ME sind, können sie unterstützend zur Diagnosestellung von ME/CFS herangezogen werden. Aktuell haben positive Neurotransmitter-Rezeptor-AAk-Befunde keine direkte therapeutische Relevanz. Detaillierte Hintergründe finden Sie in unserer aktualisierten Diagnostik-Information.
Ganglioside sind wasserunlösliche Lipide und sind Bestandteil von Zellmembranen, insbesondere im zentralen und peripheren Nervensystem. Autoantikörper (AAk) gegen Ganglioside bewirken eine Entzündung oder Demyelinisierung der Markscheiden.
Sie rufen somit eine Vielzahl verschiedener Symptome hervor und gelten als typische serologische Marker für entzündliche autoimmune Neuropathien des peripheren Nervensystems. Dazuzählen das Guillain-Barré-Syndrom, das Miller-Fisher-Syndrom oder die chronisch-entzündliche demyelinisierende Polyneuropathie. Häufig treten entzündliche Neuropathien nach Infektionen, wie z. B. EBV, Campylobacter jejuni oder CMV auf.
Das liegt daran, dass gangliosidähnliche Strukturen auch an der Oberfläche von Mikroorganismen vorkommen und sich die entsprechenden Antikörper nicht nur gegen die Erreger richten, sondern auch gegen die Ganglioside der Markscheiden oder Nervenfasern. Die daraus resultierende Klinik reicht von leichter Ermüdbarkeit und uncharakteristischem Missempfinden über neuromuskuläre Störungen bis hin zu Funktionsausfällen wie Atemlähmung und Herzstillstand. Für die Differentialdiagnostik wird die Bestimmung der Gangliosid-Autoantikörper empfohlen. So können die autoimmunen Polyneuropathien (PNP) von anderen PNP abgegrenzt werden, wie z. B. die toxische PNP, die oft in Verbindung mit toxischer Enzephalopathie (TE) auftritt. Außerdem liefern sie auch gleich therapeutischrelevante Aussagen bezüglich des Subtyps der neuropathischen Störung.
Isoliert vorkommende Gangliosid-AAk können aufgrund der Kreuzreaktivität mit mikrobiellen Strukturen auch bei Gesunden nachweisbar sein. Die diagnostische Spezifität der Gangliosid-AAk steigt mit der Anzahl der positiv nachgewiesenen Antikörper.Daher wird im IMD immer das Antikörper-Profil mit 11 verschiedenen Gangliosiden untersucht (GM1, GM2, GM3, GM4, GD1a, GD1b, GD2, GD3, GT1a, GT1b, GQ1b).

FAQ Kategorien
