Häufig gestellte Fragen (FAQ)
Oxidativer/nitrosativer Stress
Der TAS-Test (Totaler Antioxidanzien Status) ist ein 1993 als sehr einfacher Screeningtest eingeführtes Laborverfahren, um die Kapazität aller im Patientenplasma vorhandenen Oxidations-hemmenden Moleküle zu erfassen. Auch wenn das auf den ersten Blick plausibel klingt, ist der Test ungeeignet, den Versorgungsstatus oder gar Substitutionsbedarf eines Patienten einzuschätzen, weil in diesen Test neben den klassischen Antioxidanzien wie Vitamin C oder E auch Plasmaproteine wie Albumin aber auch Harnsäure und Cholesterin eingehen und das wegen ihrer großen Menge sogar überproportional. Das erklärt sich in Kenntnis des Testprinzips. Es wird die hemmende Wirkung des Gesamtplasmas auf die Oxidation von ABTS (2,2′-Azino-di-3-ethylbenzthiazolinsulfat) durch zugegebenes Metmyoglobin erfasst wird. So wird z.B. ein Patient mit Gicht (hohe Harnsäure) oder Fettstoffwechselstörung (hohes Cholesterin) im TAS-Test oft eine gute antioxidative Kapazität zeigen, obwohl der Patient signifikante Defizite beim Coenzym Q10, Vitamin E oder Glutathion hat. Patienten mit niedrigem Gesamtprotein (Albumin) oder Patienten mit durch Fettsenker stark verminderten Cholesterinwerten haben dagegen immer schlechte Werte, selbst wenn die einzelnen echten Antioxidanzien in ausreichender Menge vorhanden sind. Die zellulären Anteile, so z.B. das intrazelluläre Glutathion, werden gar nicht erfasst, weil zellfreies Plasma eingesetzt wird. Es erfolgt keine Differenzierung zwischen wasser- und lipidlöslichen (zellgängigen) Antioxidanzien.
Die 2008 erschienene Empfehlung des Robert-Koch-Institut "Oxidativer Stress und Möglichkeiten seiner Messung aus umweltmedizinischer Sicht" rät von der Verwendung des TAS-Test ab mit der Begründung, dass es heute die Möglichkeit gibt, die entscheidenden Antioxidanzien direkt im Labor zu analysieren und sie entsprechend der gefundenen Spiegel gezielt zu substituieren.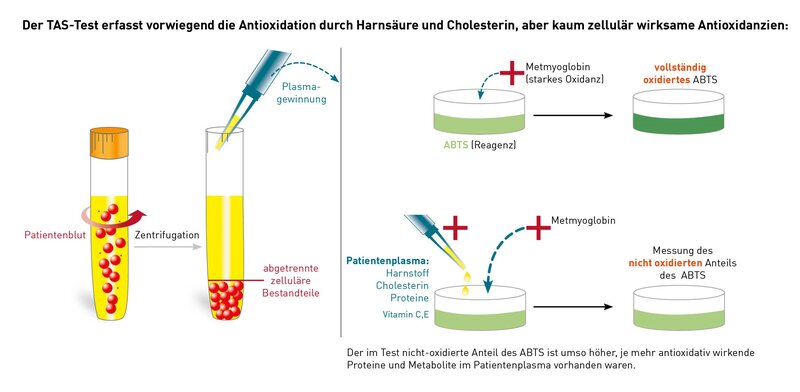
Der Hauptgrund ist, dass nur die reduzierte Form (GSH) intrazellulär bestimmbar ist. Die oxidierte Form (also GSSG) kann man dagegen nicht in Leukozyten sondern nur im Serum (oder lysiertem Erythrozytenkondensat) bestimmen, was aufgrund der intrazellulären Bedeutung wenig Sinn macht. Wir halten (abgesehen von akademischen Fragen) die reduzierte Form intrazellulär in Leukozyten echten gemessen für ausreichend, denn daran wird man immer den Substitutionsbedarf festmachen. Zudem hat die parallele Bestimmung in Monozyten und Lymphozyten eine entscheidende Zusatzaussage. Da Monozyten, nachdem sie aus dem Knochenmark übergetreten sind, nur 24-48 h im Blut zirkulieren und nach Auswanderung nie zurück ins Blut rezirkulieren, ist ein nachweisbarer GSH-Mangel in Monozyten immer Hinweis auf Synthesemängel (Synthesemängel oder Mangel an SH-Gruppen spendenden Aminosäuren) oder GSH-Verlust (Ausscheidung schadstoffkonjugierter GSH-Moleküle über die Niere). Wenn dagegen auch die Lymphozyten als zwischen Gewebe und Blut permanent rezirkulierende Zellen betroffen sind, dann spricht das für einen GSH-Verbrauch (z.B. durch entzündliche Prozesse oder toxische (Über)belastungen. Das intrazelluläre GSH hat zwei wichtige Funktionen. Zum einen dient GSH als Redox-Puffer, d.h. es hilft, zelluläre Proteine und Membranlipide vor „freien Radikalen“ zu schützen. Dabei wird Glutathion oxidiert und geht von seiner monomeren Form GSH in das Dimer GSSG über. Die zweite Funktion ist die Biotransformation von Schadstoffen in der Phase-II-Entgiftung. Dabei katalysiert die zytosolisch lokalisierte Glutathion-S-Transferase die Reaktion von GSH mit Halogen-, Sulfat-, Sulfonat-, Phosphat- und Nitro-Gruppen aber auch Metallionen. Mit GSH konjugierte Stoffe sind wasserlöslich und werden über die Niere und auch biliär besser ausgeschieden. Das so „verbrauchte“ GSH würde sich nicht im Anstieg von GSSG wiederspiegeln. Daher wird deutlich, dass GSSG nur für seine Funktion als Redox-Puffer eine Aussage liefern würde, selbst wenn man es intrazellulär bestimmen könnte.
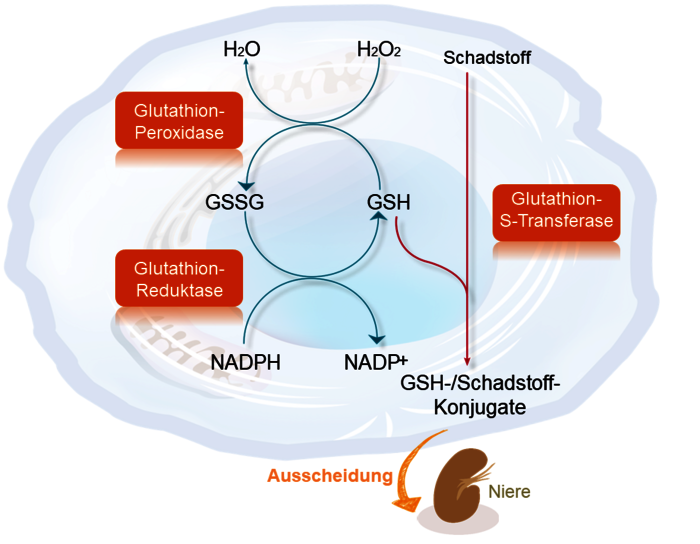

Die getrennte Bestimmung in Monozyten und Lymphozyten erlaubt eine Aussage darüber, ob ein Glutathionmangel durch verstärkten Verbrauch bedingt ist oder durch einen Mangel an „Rohstoffen“ für die Gluathionssynthese, insbesondere Cystein.
Monozyten zirkulieren nach Übergang aus dem Knochenmark nur 24 h im Blut, gehen dann ins Gewebe und kommen nicht zurück ins Blut. Ein niedriges GSH in Monozyten zeugt somit von einem primären Mangel an Cystein oder (selten) einem GSH-Synthesedefekt.
Lymphozyten rezirkulieren zwischen Gewebe und Blut. Insofern spiegelt das GSH in Lymphozyten eher den „Verbrauch“ im Gewebe wieder bzw. die reduzierte Regeneration.
In der Praxis zeigt also ein vermindertes GSH in Lymphozyten bei normalem Monozytenwert, dass das GSH sekundär aufgrund einer Immunaktivierung oder verstärkten prooxidativen Belastung reduziert ist. In diesem Fall wäre eine Glutathion- oder ACC-Substitution allein wenig erfolgversprechend, sondern sie sollte von einer antientzündlichen und/oder antioxidativen Therapie begleitet sein.
Die zusätzliche Bestimmung in NK-Zellen begründet sich durch die essentielle Rolle der NK-Zellen im Rahmen der Tumorimmunität. Heparinblut wird von uns dem EDTA-Blut vorgezogen, weil Heparin ein physiologisches Antikoagulanz ist. EDTA entzieht als Chelatbildner dagegen den Zellen Calcium (und andere Spurenelemente). Ein Calciummangel während des Bluttransportes ins Labor kann für einen artifiziellen GSH-Mangel und somit falsch niedrige Werte verantwortlich sein.

Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 163
Malondialdehyd (MDA) ist das Endprodukt des oxidativen Fettsäureabbaus (Lipidperoxidation). Die Bestimmung von MDA im Urin oder Blut ist allerdings nicht praktikabel, da die biologischen zeitlichen Schwankungen groß sind und wegen der geringen Stabilität ein Transport der Patientenprobe ins Laborin gefrorenem Zustand erfolgen müsste. In der Praxis hat sich aufgrund der unkomplizierten Präanalytik und der geringen biologischen Schwankungen das Malondialdehyd-modifizierte LDL (MDA-LDL) etabliert. Dabei handelt es sichum das Blutfettmolekül LDL, welches in Folge des „Einwirkens“ von Malondialdehyd oxidiert wird. MDA-LDL ist somit ein stabiler und verlässlicher Biomarker des oxidativen Stress. Ähnlich wie z. B. in der Diabetologie das HbA1c als Biomarker der Blutglukosepräsenz über einen Zeitraum von meheren Wochen dient, trifft man mit dem MDA-LDL eine Aussage über den im Organismus durchschnittlich über diesen Zeitraum aufgetretenen oxidativen Stress.
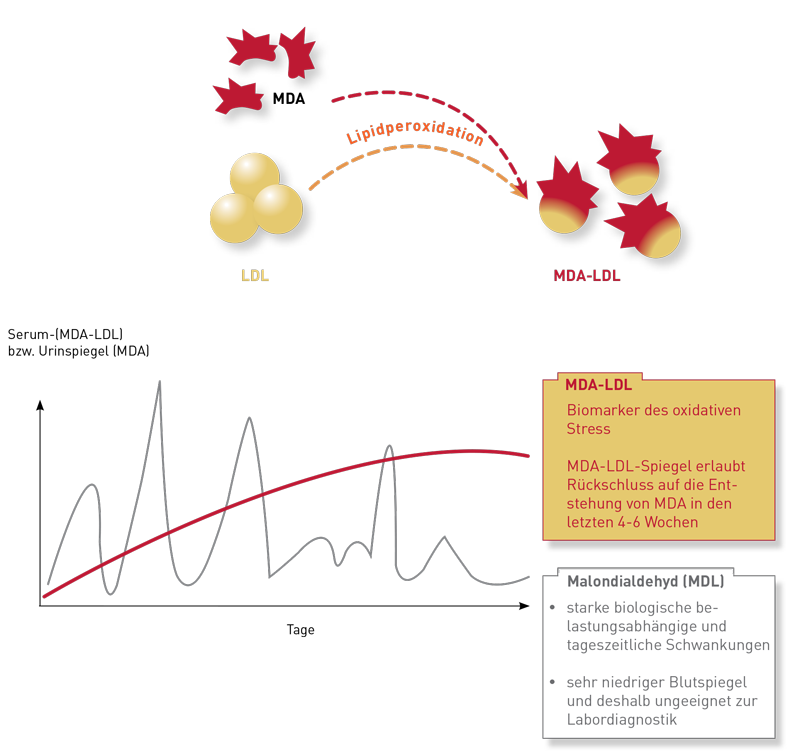
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 259
Unter oxidativem Stress versteht man ein gestörtes Gleichgewicht zwischen der Bildung freier Sauerstoffradikale (reactive oxygen species, ROS) und deren Abbau (Neutralisation) durch verschiedene Schutzsubstanzen wie zum Beispiel Antioxidantien. Freie Sauerstoffradikale entstehen nicht nur beim lebensnotwendigen Atmungs- und Verbrennungsprozess, sondern sie werden auch durch äußere Einflüsse wie Rauchen, UV-Licht, Ozon, Umweltschadstoffe und Medikamente induziert.
Neben den freien Sauerstoffradikalen können unter oxidierenden Bedingungen auch Stickstoffmonoxid- Radikale (NO*) entstehen, von denen sich das sehr reaktive Peroxinitrit ableitet. „Spender“ des Stickstoffes (N) ist vor allem die Aminosäure Arginin. Man spricht dann von „nitrosativem Stress“. Da das hoch reaktive Peroxynitrit die Aminosäure Tyrosin zu Nitrotyrosin nitriliert, dient Nitrotyrosin als Biomarker des nitrosativen Stress.
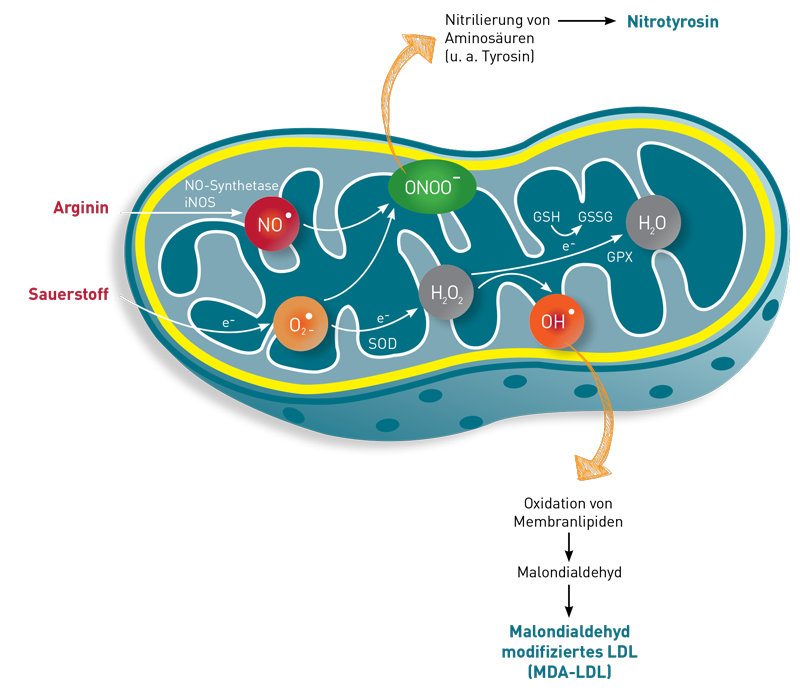
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 138
FAQ Kategorien
