Häufig gestellte Fragen (FAQ)
Metalltoxikologie
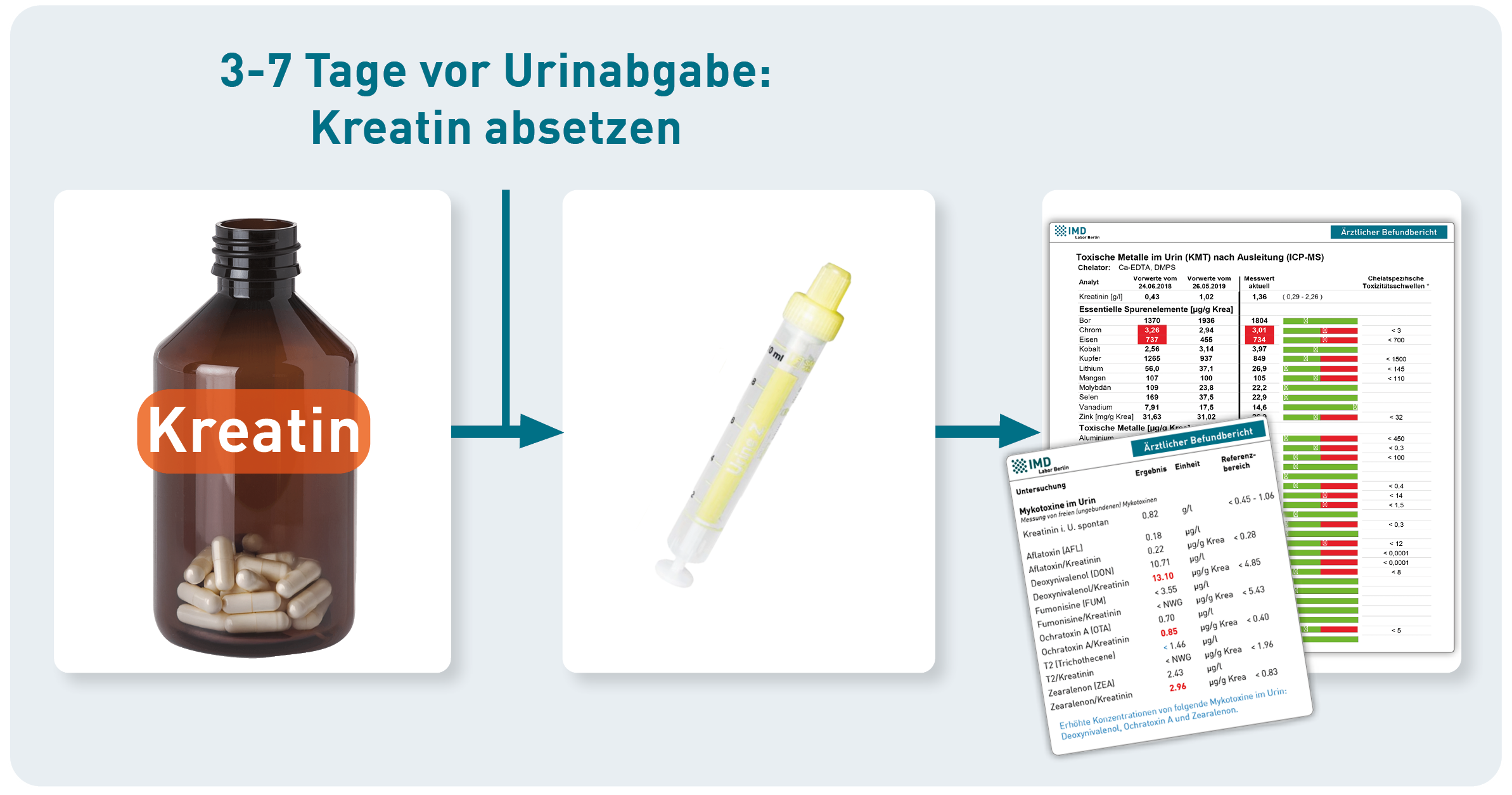
Die Konzentration von Urinparametern wird üblicherweise auf Kreatinin bezogen, um Schwankungen durch die Trinkmenge auszugleichen. Da Kreatinin im Körper aus Kreatin gebildet wird, steigern Kreatin-Supplemente die Kreatinin-Konzentration im Urin – auch ohne Veränderung der Flüssigkeitszufuhr. Die Normalisierung von Urinparametern (z. B. Mykotoxinen oder toxischen Metallen) auf Kreatinin würde bei den Betroffenen fälschlich niedrige Werte ergeben und ihre eigentliche Exposition unterschätzen lassen. Daraus ergibt sich für die Praxis:
- Vor einer Urinuntersuchung sollte Kreatin als Nahrungsergänzungsmittel 3 Tage lang nicht eingenommen werden - bei langfristiger Supplementierung (z. B. Bodybuilding) ist ein längeres Absetzen sinnvoll (bis zu 7 Tage).
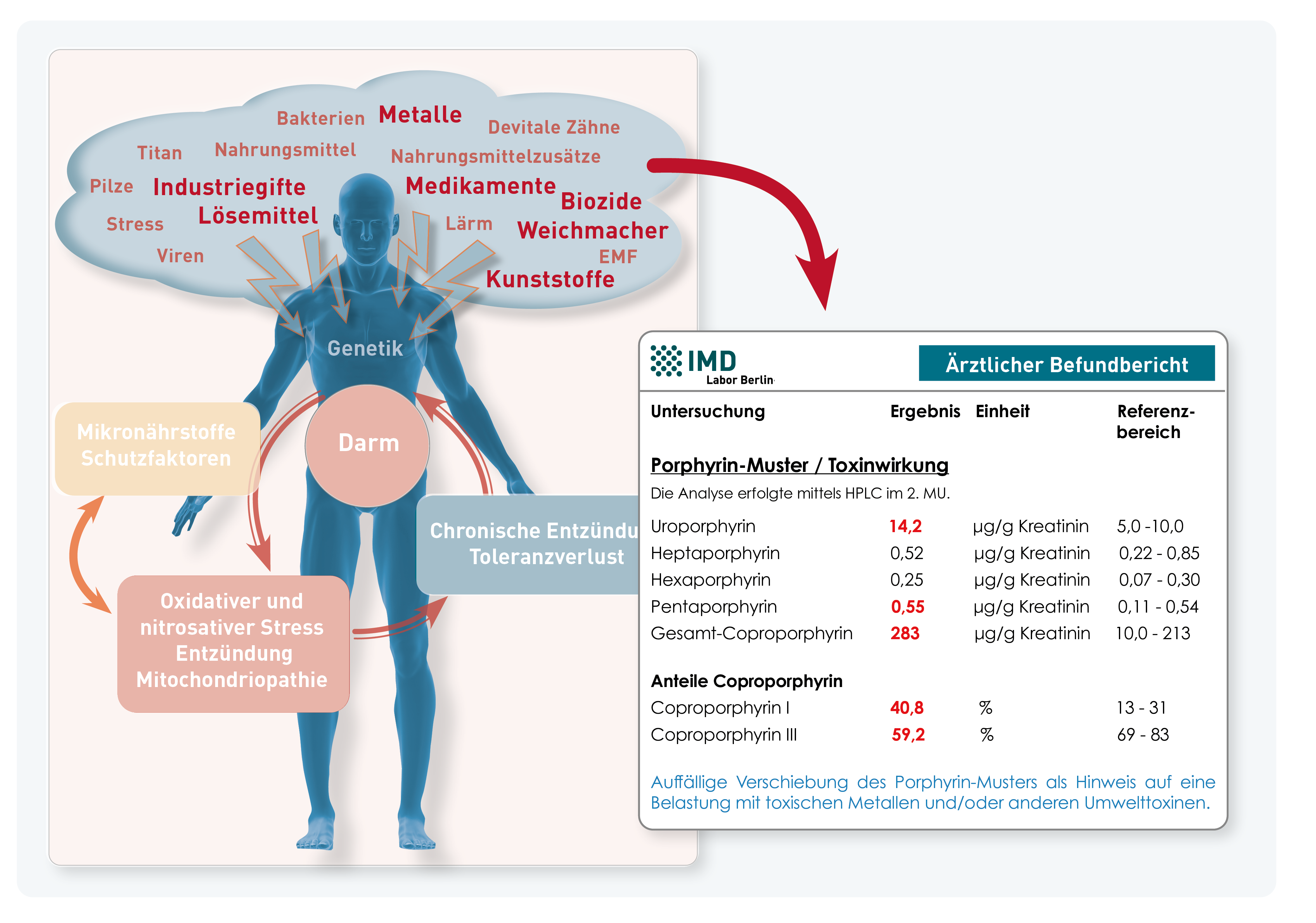
Das Porphyrin-Muster im 2. Morgenurin ist ein Biomarker für die aktuelle Belastung mit Umwelttoxinen. Hintergrund dafür ist, dass toxische Metalle, Pestizide, Flammschutzmittel und andere Fremdstoffe Enzyme des Hämstoffwechsels stören, wodurch die Ausscheidung der entstehenden Metabolite (so genannter Porphyrine) verändert wird. Das im 2. Morgenurin gemessene Porphyrin-Muster ist als Screening geeignet, über das Patienten erkannt werden können, die in besonderem Maße von Belastung mit Umwelttoxinen betroffen sind. Gleichzeitig eignet sich das Porphyrin-Muster als Verlaufsparameter, um therapeutische Maßnahmen wie die Expositionsminderung und die Unterstützung der Entgiftung zu monitoren. Weitere Hintergrundinformationen und praktische Details finden Sie in unserer Diagnostik-Information (Link zum PDF). Zu beachten ist, dass sich das Porphyrin-Muster im 2. Morgenurin nicht zur Diagnostik genetisch bedingter Porphyrien eignet, deren Diagnostik sich in Indikation und Untersuchungsmaterial (24h-Sammelharn bzw. Stuhl) unterscheidet.
Die Untersuchung von „Silizium im EDTA-Blut“ kann bei dieser Fragestellung einen Hinweis liefern. Silizium ist ein Baustein von Silikon, einer Studie zufolge weisen daher Frauen mit Silikonimplantaten durchschnittlich höhere Silizium-Konzentrationen im Blut auf. Bei erhöhtem Silizium sind allerdings auch andere Expositionsquellen zu berücksichtigen, vor allem die Aufnahme von Siliziumoxid-Nanopartikeln aus Kosmetika und Nahrungsergänzungsmitteln. Eine niedrige oder unauffällige Siliziumkonzentration hingegen spricht gegen eine vermehrte Fremdstofffreisetzung aus einem Silikonimplantat.
Gleichzeitig wird Silizium als potentiell essentielles Spurenelement und Antagonist von Aluminiumbelastungen diskutiert. Aufgrund des natürlichen Siliziumgehalts vieler pflanzlicher Nahrungsmittel weisen alle Personen eine messbare Silizium-Konzentration im Blut auf. Ein erhöhter Spiegel kann daher auch Folge der Zufuhr siliziumreicher Nahrungsmittel oder Getränke sein.
Zu geringeren Teilen können in Brustimplantaten auch Metalle wie Nickel, Platin und Zinn enthalten sein. Bei Fremdstofffreisetzung aus schadhaften Implantaten ist daher eine Belastung des umliegenden Gewebes mit diesen Metallen möglich. Ein Anstieg der Konzentrationen im EDTA-Blut wurde jedoch bisher in der Literatur nicht beschrieben.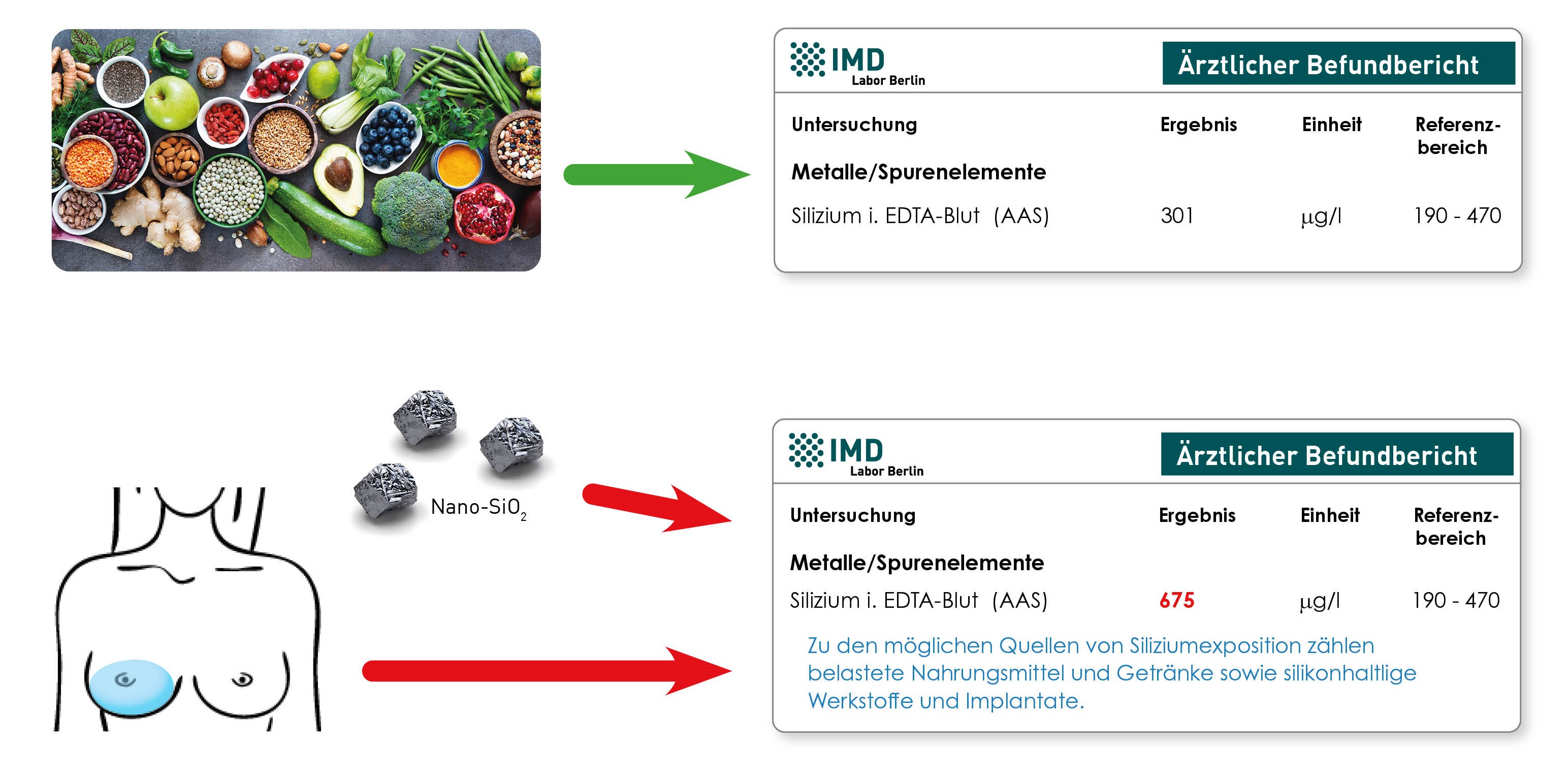
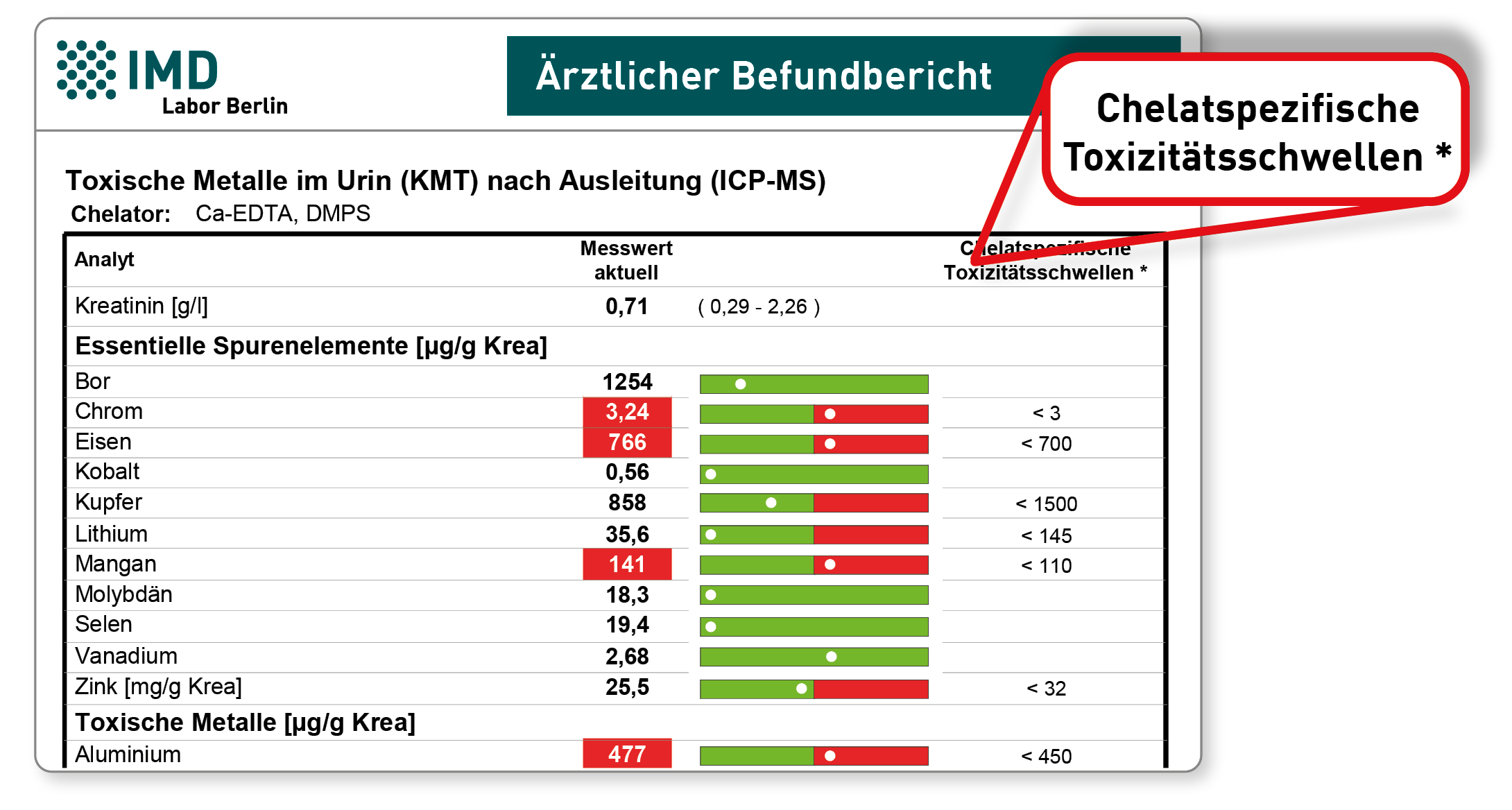
Der wesentliche Unterschied ist der Bezug der Metallwerte auf die „chelatspezifischen Toxizitätsschwellen“, die von der Ärztegesellschaft für Klinische Metalltoxikologie (KMT) für die Chelatierung mit Ca-EDTA+DMPS herausgegeben wurden. Das Chelatierungsprotokoll wird in den Weiterbildungen der KMT gelehrt. Alle Werte werden ausschließlich kreatininbezogen aufgeführt. Dadurch entsteht auf dem Befund Platz für eine grafische Darstellung (Befundbeispiel).
Das herkömmliche IMD-Profil stellt hingegen die im Urin in µg/l gemessenen Metallkonzentrationen ins Zentrum. Diese werden mit den Normbereichen des Basalurins verglichen – farblich hervorgehoben werden alle Konzentrationen, die über einen üblichen Basalurin ansteigen und damit (vermutlich) von einer Belastung des Gewebes herrühren. Die kreatininbezogenen Werte dienen hier der Verlaufskontrolle sowie ggf. einem Abgleich mit „Richtwerten“. Quelle der Richtwerte können die Auswertungen des Toxikologen Max Daunderer sein. Möglich ist es aber ebenso, aus den Messwerten der eigenen Praxis Richtwerte statistisch zu ermitteln, die zum eigenen Ausleitungsprotokoll passen. Falls dies für Sie von Interesse ist, sprechen Sie uns bitte an.
Grundsätzlich kann das „KMT-Profil“ nicht nur für die Ausleitung mit Ca-EDTA+DMPS, sondern auch nach Ausleitung mit anderen Chelatoren dargestellt werden. Es gilt jedoch die Einschränkung, dass bisher Toxizitätsschwellen für andere Chelatoren nicht verfügbar sind und daher nur die von Ca-EDTA+DMPS angezeigt werden können.
Da beide Befunddarstellungen – bei identischer Analytik – unterschiedliche Schwerpunkte haben, bieten wir sie gleichberechtigt an. Zur Anforderung des „KMT-Profils“ bitten wir um Verwendung des neuen Scheins „Metalltoxikologie“, oder alternativ um den handschriftlichen Hinweis „KMT“ neben Analyse 271 auf dem Schein „Spezielle Immundiagnostik“. Das herkömmliche Profil kann wie bisher auf den „Immundiagnostik“-Scheinen angekreuzt werden.
Der Kreatininbezug hat Vor- und Nachteile. Die kreatininbezogenen Metallwerte (μg/g Krea) sind geeignet, um schwankende Urinkonsistenzen (Diureseeffekte) zu berücksichtigen. Der Kreatininwert hängt aber auch von anderen Faktoren ab wie der Muskelmasse, der Nierenfunktion, Ernährungsgewohnheiten und der Medikamenteneinnahme.
Alle diese Faktoren können das Resultat im Urin verfälschen, wenn man die Messwerte kreatininbezogen darstellt. Bei einem Patienten mit hoher Muskelmasse und damit einhergehendem hohen Serumkreatinin würde man einen hohen Urinmetallwert verharmlosen, da man ihn durcheine Kreatininnormalisierung „runterrechnen“würde.Gleiches gilt für Patienten mit (auch leicht) verminderter Nierenfunktion, was gerade bei metallbelasteten Patienten nicht selten vorkommt. Daher geben wir die Referenzbereiche der Metalle im Urin in der Einheit μg/L an und folgen damit auch den Empfehlungen der WHO und des Umweltbundesamtes.
Anders ist es bei Verlaufsuntersuchungen. Hier müssen dagegen die kreatininbezogenen Metallwerte berücksichtigt werden, da Muskelmasse, Nierenfunktion und andere Einflussfaktoren bei einem Patienten mehr oder weniger als konstant angenommen werden können.

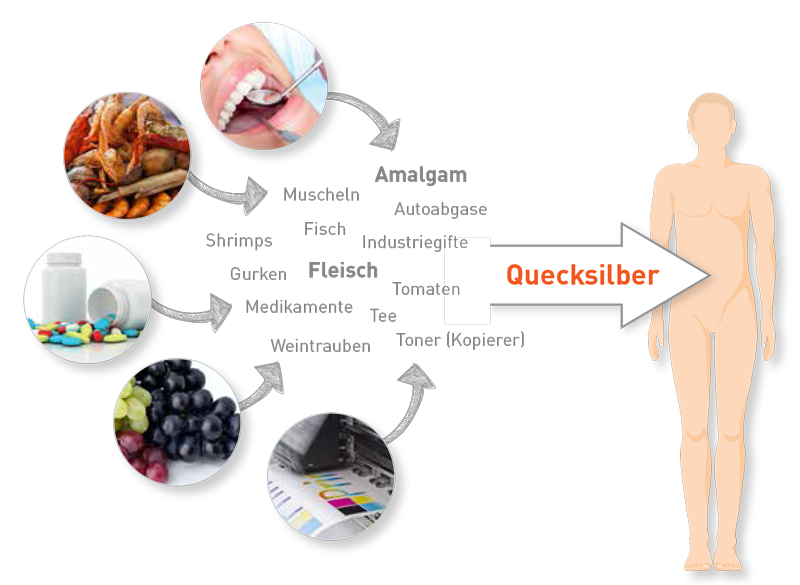
Da Quecksilber keine physiologische Funktion hat, gilt grundsätzlich „je weniger desto besser“. Auch bei geringen Gesamt-Quecksilberspiegeln im Blut ist eine Beeinträchtigung des Spurenelementhaushaltes und der endogenen antioxidativen Kapazität nicht auszuschließen. Erhöhte Spiegel bis etwa 5 μg/L sind noch als leichte Belastungen anzusehen. Für die Einschätzung ihrer Schädlichkeit ist die Belastungsdauer besonders wichtig. Handeltes sich um eine gelegentliche Exposition – zufällig zum Zeitpunkt der Blutuntersuchung – oder resultiert der Messwert aus einer permanent vorhandenen Quelle?
Diese Unterscheidung erfordert neben einer möglichen Kontrolle des Quecksilberwertes (nach etwa drei bis vier Wochen) eine Abklärung der individuellen Essgewohnheiten. Neben Fisch, Muscheln und Meeresfrüchten können auch zahlreiche weitere Lebensmittel mit Quecksilber belastet sein. Eine Studie aus dem Jahr 2014 zeigte z. B., dass der Quecksilbergehalt in Gemüse im Durchschnitt ein Drittel des Gehaltes in Fisch beträgt, Geflügel und anderes Fleisch sogar 70-80 %. Der Belastungsgrad der Agrarprodukte hängt dabei von der Boden- und Umweltbelastung ab. Obst und Gemüsesäfte sowie Weine können in Einzelfällen hohe Quecksilbermengen enthalten, v. a. wenn sie in der Nähe von Fernverkehrsstraßen, Müllverbrennungsanlagen oder Kohlekraftwerken wachsen. Früchte können auch durch quecksilberhaltige Spritzmittel belastet sein, v. a. bei importierten Früchten. Die unmittelbare inhalative Belastung aus Abgasen, Kaminen oder auch über Tonerstäube stellen weitere Belastungsquellen dar.
Eine weitere Ursache geringer, aber konstanter Quecksilberspiegel kann auch der Austausch zwischen Gewebe und Blut sein. Die Quecksilberquelle stellt in diesem Fall der Gewebe-Speicherpool aus früheren Exposition dar. Diese „Quelle“ wäre nur durch eine Chelattherapie (Ausleitung) langsam abzubauen.
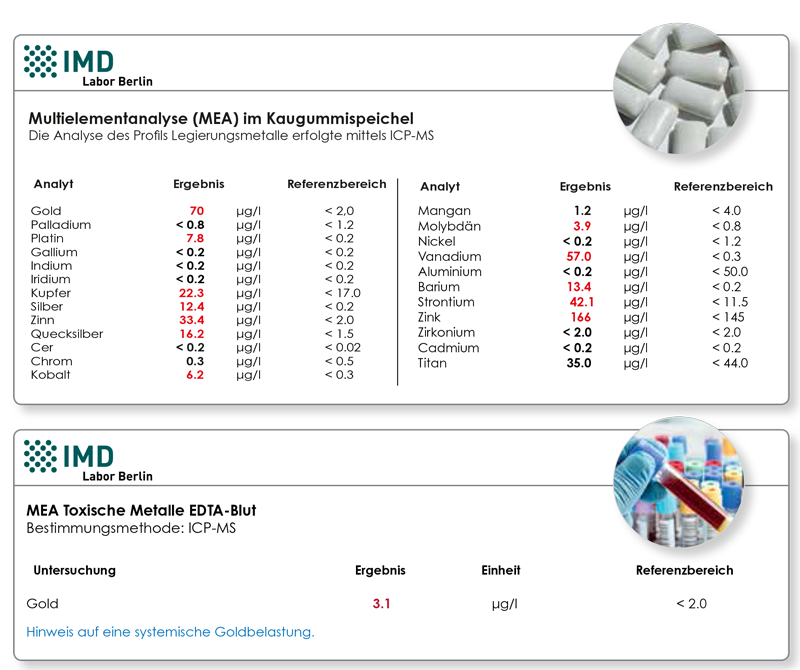
Wenn ein Patient ein bestimmtes Metall als Zahnersatz im Mund hat, dann ist eine zumindest geringgradige Freisetzung in den Speichel immer vorhanden. Goldwerte von etwa 70 -100 μg/L messen wir regelmäßig bei Patienten, die Goldlegierungen im Mund haben – es handelt sich um einen deutlich erhöhten, aber nicht extremhohen Wert. Wichtig ist es, die Konzentration auf Anzahl bzw. Menge des eingesetzten Materials zu beziehen: Sind es 10 Kronen, möglicherweise aus einer weichen Goldlegierung? Dann wäre ein Wert von 70 μg/L „erwartungsgemäß“, da er den Eigenschaften und der Menge des verwendeten Materials entspricht.
Oder ist es ein einziges kleines Inlay, aus dem die gemessene Metallmenge frei wird? Dann wäre ein Wert von 70 μg/L ungewöhnlich hoch. Über die Fähigkeit des individuellen Patienten, eine permanente orale Metallexposition dieser Höhe zu kompensieren, kann die Spiegelbestimmung im Speichel keine Aussage treffen. Neben der klinischen Beurteilung spielen hier insbesondere die Darmbarrierefunktion (messbar über das Zonulin im Serum), das antioxidative Schutzsystem (Antioxidantien, Spurenelemente),sowie die Ausscheidungs- und Entgiftungskapazität (Nierenfunktion, Entgiftungsgenetik) eine wichtige Rolle. Um die systemische Belastung zu untersuchen, wäre in diesem Fall die nachfolgende Bestimmung im Blut (EDTA-Blut) sinnvoll. Bei bestehen der Typ IV-Sensibilisierung (messbar im LTT) ist eine Unverträglichkeitsreaktion aber unabhängig von der Höhe der gemessenen Metallkonzentration zu erwarten.
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 295, 304
FAQ Kategorien
