Häufig gestellte Fragen (FAQ)
Nahrungsmittelunverträglichkeit und leaky gut
Da bei Zöliakie bereits der Verzehr kleinster Mengen Gluten zu einer Schädigung der Darmschleimhaut führt und das Risiko für Spätfolgen wie z.B. Infertilität, Osteoporose, Ataxie, Neuropathie, Nephropathie, Hepatitis und Myalgien steigert, müssen sich Betroffene lebenslang glutenfrei ernähren. Als unbedenklich gilt ein Schwellenwert von 10 mg Gluten/Tag, was ca. 10 Brotkrümeln oder 1/3 eines Brotcroutons entspricht. Doch selbst glutenfreie Produkte sind nicht gänzlich frei von Gluten: In Europa gilt ein Erzeugnis als „glutenfrei“, wenn es weniger als 0,02% bzw. 20 mg/kg Gluten enthält. Somit kann der Verzehr von 250g glutenfreiem Brot zum Frühstück und 250g glutenfreier Pasta zum Mittagessen bereits den Schwellenwert erreichen. Die notwendige strikt glutenfreie Diät bedeutet daher für Patienten und Angehörige einen hohen Aufwand und eine Einschränkung der Lebensqualität.
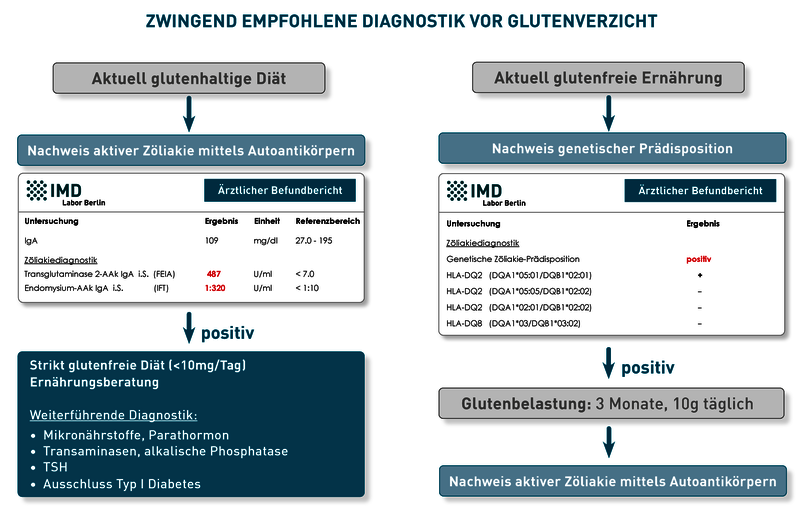
Patienten, die unter Glutensensitivität leiden oder Gluten aus anderen Gründen schlecht vertragen, sind bezüglich ihrer Glutenkarenz weniger strengen und starren Regeln unterworfen. Eine differentialdiagnostische Abgrenzung zur Zöliakie ist daher sehr wichtig, kann jedoch nur unter glutenhaltiger Kost erfolgen (Diagnostik-Schema: siehe Abbildung). Ein detaillierter Vorschlag zur Labordiagnostik bei Verdacht auf Weizenunverträglichkeit kann auch unsere neuen Diagnosekarte (Link zum PDF) entnommen werden (als Karte bestellbar über SI.Service@IMD-Berlin.de).
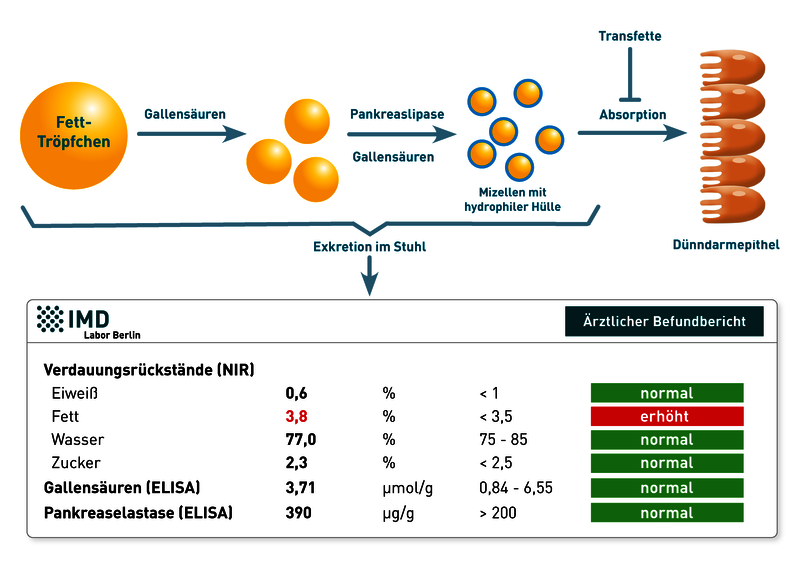
Bei der Analyse von Verdauungsrückständen im Rahmen der Stuhldiagnostik ist ein erhöhter Fettanteil in der Regel auf zwei mögliche Ursachen zurückzuführen
(1) Störung der Fettverdauung:
- Eine ungenügende Produktion von Verdauungsenzymen durch die Bauchspeicheldrüse (exokrine Pankreasinsuffizienz) führt zu einem Mangel an Pankreas-Lipase, dem wichtigsten Abbauenzym von Fetten im Dünndarm. Die Folge ist eine unvollständige Fettaufspaltung und Resorption. Die diagnostische Abklärung ist über die PankreasElastase im Stuhl möglich. Dieser Marker wird im Gegensatz zu anderen Pankreasenzymen nicht im Darm abgebaut und kann daher als Parameter für die exokrine Pankreas-Funktion genutzt werden.
- Ein Mangel an Gallensäuren beeinträchtigt die Emulgierung von Fetten und damit die Bildung der vom Darmepithel absorbierten Mizellen aus Gallensäuren, Fettsäuren, Lipiden und fettlöslichen Vitaminen. Auch die Effizienz der Pankreas-Lipase sinkt, da bei verminderter Mizellenbildung die Oberfläche der zu verdauenden Fetttropfen im Darm insgesamt verkleinert ist und das Enzym dadurch weniger Angriffsfläche hat. Charakteristisch für diese Störung der Fettverdauung sind niedrige Werte für Gallensäuren im Stuhl.
(2) Ernährungsfehler
- Ist wie im unten gezeigten Befundbeispiel der Fettanteil im Stuhl erhöht, während Pankreas-Elastase und Gallensäuren im Normbereich liegen, weist diese Konstellation auf Ernährungsfehler hin, wie z.B. einen erhöhten Fettanteil der Ernährung. Auch erhöhte Zufuhr von Transfetten (enthalten in hoch-verarbeiteten Produkten wie Fertiggerichten, Chips oder Backwaren) kann die Absorption von Fetten inhibieren und somit zu einer höheren Exkretion von Fett führen. Um Ernährungsfehler erkennen zu können, sollten Patienten in den Tagen vor der Analyse ihren üblichen Ernährungsgewohnheiten folgen.
Unabhängig von der Ursache, sollte unbedingt beachtet werden, dass eine weniger effiziente Verdauung und Resorption von Fetten im Dünndarm eine verminderte Aufnahme der fettlöslichen Vitamine A, D, E und K nach sich zieht.
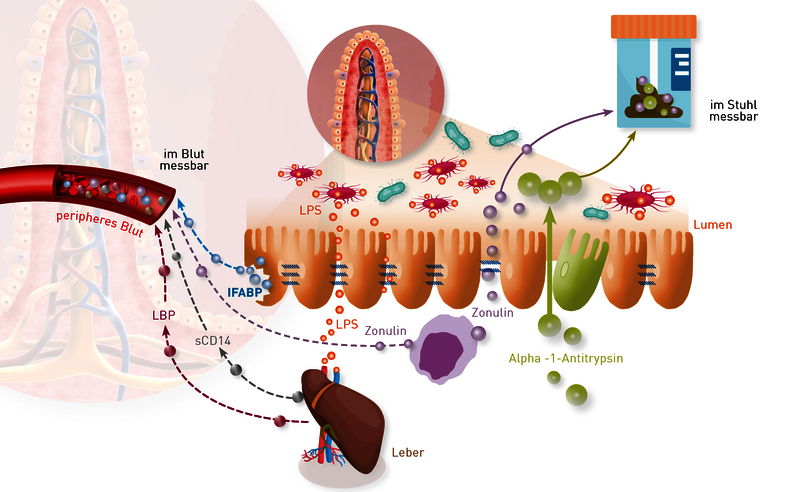
Für den Nachweis einer gestörten Darmbarriere („leaky gut“) stehen mehrere Labormarker zur Verfügung, die sich nach unseren Erfahrungen leider oft widersprechen und nicht parallel ansteigen. Einen stereotypen Laborbefund des leaky-gut-Syndroms gibt es nicht. Die unterschiedlichen Laborbefundkonstellationen beruhen auf unterschiedlichen klinischen Manifestationen und der Heterogenität der damit einhergehenden Darmepithelschädigungen. Auch mit Hinblick auf die unterschiedliche Physiologie der verschiedenen Darm-abschnitte gibt es nicht das eine klinische Bild des leaky-gut-Syndroms.
Was sind gebräuchliche leaky-gut-Parameter? Wir haben für Sie die relevanten Serum- und Stuhlparameter und ihre Bedeutung zusammengestellt (Link zur Übersicht).
Die verlinkte Übersicht über die Laborparameter zeigt klar: leaky gut ist nur durch parallele Serum- und Stuhlanalyse sicher nachzuweisen. Aufgrund der unterschiedlichen Physiologie, der Abhängigkeit einer Induktion vom leaky-gut-Auslöser (wie Entzündung, toxische Einflüsse, vegetativer Stress) und Morbiditätsfaktoren (proinflammatorische Dysbiose, Leberfunktion u.ä.), ist bei Diskrepanzen immer der auffälligere Marker ausschlaggebend. Die dringend notwendige Evaluation der genannten Marker und die Erarbeitung diagnostischer Empfehlungen bei verschiedenen Krankheitsbildern auch in Abhängigkeit von anderen Labormarkern (proinflammatorische Dysbiose? Erhöhung von Darm- und systemischen Entzündungsmarkern? Leberfunktion?) ist Gegenstand aktueller Untersuchungen am IMD Berlin.
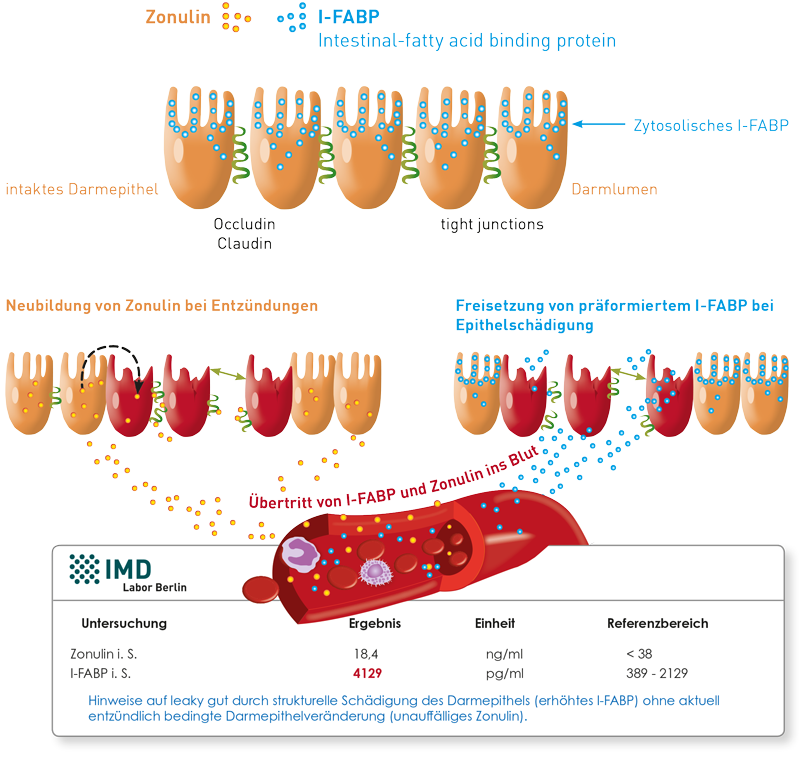
Dies ist durch ihre unterschiedliche Regulation bedingt. Zonulin ist ein Protein, welches zur entzündungsassoziierten Properdin-Familie gehört. Es wird von Darmepithelzellen des Dünndarms sezerniert und ist selbst an der Öffnung der tight junctions und somit an der Erhöhung der Durchlässigkeit des Darmepithels beteiligt. Voraussetzung für die Sekretion von Zonulin sind 1. ein inflammatorisches Signal (Entzündung) und 2. eine Mindestmenge an intakten Darmepithelzellen, die noch Zonulin produzieren können. I-FABP (intestinal- fatty acid binding protein) liegt hingegen präformiert in den Mikrovilli der Darmepithelien vor. Es ist nicht inflammatorisch kontrolliert. Seine originäre Aufgabe ist die Durchschleusung von aus der Nahrung aufgenommenen Fettsäuren durch die Darmepithelzelle. I-FABP wird bei jeglicher struktureller Schädigung des Darmepithels passiv freigesetzt und tritt dann ins Blut über. Die genannten Unterschiede bewirken, dass Zonulin vorrangig in der Initialphase entzündlich bedingter intestinaler Veränderungen hochreguliert wird, während es sich in der chronischen Phase normalisieren kann, wenn das Darmepithel funktionell schon beeinträchtigt ist. In der späteren Phase scheint I-FABP Sensitivitätsvorteile zu haben, wie auch bei allen nicht-entzündungsbedingten Darmepithelschädigungen, z.B. bei Mangeldurchblutung (auch Stress-bedingt, z.B. gezeigt nach Fahrradergometerbelastung) oder bei toxisch bedingtem leaky gut (nach Antibiotikatherapie, toxischer Metallbelastung). Interessant sind Arbeiten, die bei Patienten mit AIDS-Erkrankungen und auch Depression zeigen, dass mit fortschreitender bzw. schwerwiegenderer Erkrankung I-FABP ansteigt und Zonulin eher abfällt. Während dies bei AIDS-Patienten noch dadurch zu erklären ist, dass das Darmepithel bei Erkrankungsprogression schwerer in Mitleidenschaft gezogen ist, wird für die diskrepanten Veränderungen bei Depression der regulierende Einfluss des vegetativen Nervensystems diskutiert.
Unsere bisherigen Ergebnisse zeigen, dass zwischen beiden Markern keine Korrelation besteht, so dass beide Marker unabhängig voneinander ein leaky gut anzeigen können.
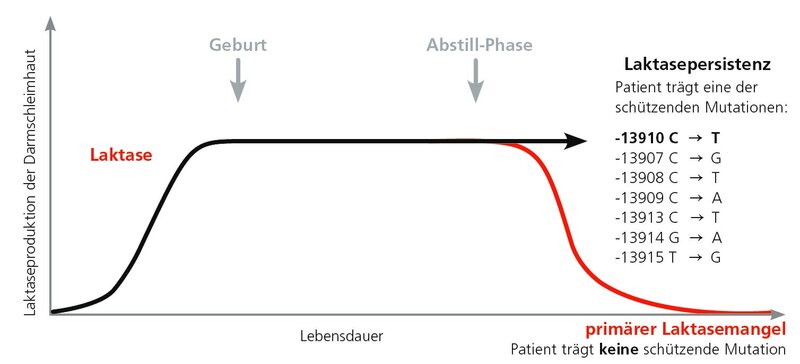
Wie bei allen Säugetieren sinkt auch beim Menschen die Produktion des Milchzucker (Laktose)-spaltenden Enzyms Laktase nach dem Abstillen. In Populationen, die Milchwirtschaft betreiben, sind vor ca. 7500 Jahren schützende Genveränderungen entstanden, die dem Träger eine lebenslange Laktase-Persistenz sichern. So ist in Europa als Anpassung an den lebenslangen Verzehr von Milchprodukten im Laktase-Gen an der Stelle-13910 ein Cytosin (C = Laktaseproduktion nimmt ab) gegen ein Thymidin (T= Laktasepersistenz) ausgetauscht worden. Bei Menschen, die diese schützende Genveränderung nicht tragen, nimmt die Laktase-Produktion im Laufe des Lebens ab, und es entsteht eine primär adulte Laktoseintoleranz. Dies betrifft in Mitteleuropa etwa 15-20 % der Bevölkerung.
Parallel zur europäischen Entwicklung hat auch in anderen Regionen eine Anpassung an den lebenslangen Verzehr von Milchzucker stattgefunden. Auf dem afrikanischen Kontinent sind die folgenden mit Laktase-Persistenz einhergehenden Varianten im Laktase-Gen entstanden: C-13907G, C-13908T, C-13909A, C-13913T, G-13914A und T-13915G.
Die Bezeichnung „afrikanische“ Mutationen bezieht sich darauf, dass diese Genvarianten während der Evolution erstmals in Afrika auftraten. Das bedeutet jedoch keinesfalls, dass sie in der heutigen Zeit nur bei Afrikanern vorkommen. Bereits durch vorgeschichtliche Völkerwanderungen haben sich die Varianten des Laktase-Gens „verteilt“. Sie treten in ca. 8 % der Fälle auf, die in unserem Labor untersucht werden. Diese zusätzlichen Mutationen können also auch Patienten tragen, deren Familien keine Wurzeln in Afrika haben.
Routinemäßig wird am IMD zunächst die häufigere kaukasische Variante C-13910T untersucht. Liegt diese schützende Mutation vor, ist eine primär adulte Laktoseintoleranz ausgeschlossen. Bei Patienten, die diese Genvariante nicht tragen, erkennt die angewandte Technik, ob andere schützende Mutationen in der Genregion vorliegen. Diese werden dann mittels Sequenzierung ausdifferenziert. Das hat die Konsequenz, dass bei 8 % der Patienten eine andere schützende Mutation (=Laktase-Persistenz) festgestellt werden kann. Bei diesen Patienten ist dann ebenfalls eine primär adulte Laktoseintoleranz ausgeschlossen, was den Befundbericht grundlegend ändert. Diese Patienten hätten ohne die Untersuchung auf die afrikanische Variante fälschlich den Befund erhalten, dass keine schützende Mutation und somit eine primär adulte Laktoseintoleranz vorliegt.
Leaky gut (engl. durchlässiger Darm) bedeutet, dass die Barrierefunktion der Darmschleimhaut im Bereich des Dünndarms gestört ist. Die Behandlung des leaky gut stellt eine wichtige Säule in der Therapie chronisch entzündlicher Erkrankungen dar. Sowohl zur Diagnosestellung als auch zur Therapiekontrolle sind non-invasive Labormarker wichtig. Als Referenzmethode gilt der Laktulose/ Mannitol-Quotient, der aber wegen des Aufwandes kaum praktikabel ist. Vielfach genutzt werden die Stuhlmarker α1-Antitrypsin, sIgA und Calprotectin, wobei die letzten beiden streng genommen eher Entzündungsmarker sind, weshalb sie bei Ischämie-, Stressoder toxisch bedingtem leaky gut kaum ansteigen. Ein in der Vergangenheit häufig verwendeter Blutmarker ist das Zonulin, ein von Enterozyten sezerniertes Protein, welches für die Öffnung der tight junctions verantwortlich ist. Allerdings kann bei schwerer Schädigung des Darmepithels wegen der in geschädigten Enterozyten gestörten Zonulinproduktion ein Zonulinanstieg auch ausbleiben. Bei Patienten mit Depression ist das Plasma-Zonulin sogar vermindert trotz erhöhtem I-FABP und zwar am niedrigsten bei den Patienten mit hohem Symptomscore. Ein Anstieg des Zonulins im Stuhl oder Blut ist, erklärbar durch dessen regulative Funktion, an eine „normale“ Darmfunktion gebunden. Das erklärt auch, dass es manchmal unter Therapie zum Anstieg des Zonulins kommt.
Wir empfehlen, I-FABP im Serum zu messen. Das Intestinal-fatty acid binding protein I-FABP ist hochspezifisch für Darmepithelien. Es wird im oberen Teil der Villi in reifen Enterozyten des Dünndarms exprimiert und bei morphologischer oder funktioneller Enterozytenschädigung in den Blutkreislauf freigesetzt. Der I-FABP-Serumspiegel korreliert nachweislich zur Pathologie und zur Laktulose/ Mannitol-Ratio. Erhöhte Werte und eine Korrelation zu den Symptomscores wurden nachgewiesen bei Zöliakie, Nicht-Zöliakie-Weizensensitivität, Mesenterialinfarkt, Nekrotisierender Colitis, Depression und auch schwerer körperlicher Belastung (Leistungssport). Wegen seiner kurzen Halbwertszeit ist I-FABP sehr gut zur Therapiekontrolle geeignet.

Eine Weizenunverträglichkeit kann durch die Autoimmunerkrankung Zöliakie bedingt sein. Dabei wird durch das im Weizen vorkommende Gluten eine chronische Entzündung der Dünndarmschleimhaut hervorgerufen. Der Nachweis von Autoantikörpern gegen Transglutaminase und gegen Endomysium im Serum ermöglicht die Diagnostik einer aktiven Zöliakie. Bei unklaren serologischen Befunden, oder Patienten, die bereits eine glutenfreie Diät eingehalten haben, ist die Untersuchung auf die HLA-Merkmale DQ2, DQ7 und DQ8 wertvoll. Nur Träger mindestens eines dieser HLA-Merkmale können eine Zöliakie entwickeln, ein fehlender Nachweis dieser Merkmale schließt eine Zöliakie daher sicher aus.
Als weitere Ursache für eine Weizen-Unverträglichkeit kommen Allergien in Betracht.Die Sensibilisierung kann auf der Bildung vonIgE-Antikörpern (Typ I-Allergie) oder spezifischen Lymphozyten (Typ IV-Allergie) beruhen.Zum Ausschluss von Typ I-Allergien auf Weizen empfiehlt sich die Untersuchung auf allergenspezifisches IgE gegen Weizen (f4), Gliadin (f98)und Gluten (f79). Treten nach körperlicher Belastungund anschließendem Genuss von Weizenprodukten Symptome auf, sollte an die selten vorkommende „Weizenabhängige anstrengungsinduzierte Anaphylaxie (WDEIA)“ gedacht werden. Die Diagnostik erfolgt hier durch die Bestimmung des IgE gegen ω5-Gliadin (f416).
Bei Verdacht auf eine Typ IV-Sensibilisierung auf Weizen empfiehlt sich der LTT auf Weizen und Gluten.Sowohl den Weizen-Allergien als auch der Zöliakie liegen klare Pathomechanismen zugrunde,weshalb spezifische Laborparameter wie Autoantikörper, IgE-Antikörper oder der Nachweis spezifischer T-Zellen zur Verfügung stehen. Heute weiß man, dass Weizen aber auch das unspezifische Immunsystem aktivieren kann. Bei dieser sogenannten Weizensensitivität stehen bisher keine(Weizen)-spezifischen Messparameter zur Verfügung.Somit gilt nach derzeitigem Stand eine„Nicht-Zöliakie-Nicht-Weizenallergie - Weizensensitivität“als wahrscheinlich, wenn Weizen-Allergien und eine Zöliakie sicher ausgeschlossen sind, sowie wenn sich nach Weizen-Elimination die Symptome bessern und nach Weizenprovokation wieder auftreten.

Nein, das ist nicht egal. Das Zonulin im Blut bzw. Serum ist besser geeignet, wenn man beim Patienten "leaky gut" untersuchen möchte.Die bei Patienten mit chronisch entzündlichen Darmerkrankungen oder Reizdarm sowie gesunden Probanden erhobene Blut- und Stuhlergebnisse sind nicht identisch bzw. zeigten oft nicht einmal tendenziell eine direkte Beziehung zueinander.
Lediglich in einer Subgruppe von Patienten mit akut exazerbiertem Morbus Crohn konnten wir bei erhöhten Blutwerten auch gleichzeitig hohe Zonulinspiegel im Stuhl messen. Bei allen anderen Patienten mit gastrointestinalen Erkrankungen und Gesunden zeigte sich in unseren Vergleichsanalysen keine Korrelation.
Wie ist das zu erklären? Die wichtigste Ursache ist, dass das Zonulin, was im Stuhl messbar ist, vor allem aus dem Dickdarm herrührt. Das im Dünndarm in das Darmlumen abgegebene Eiweiß Zonulin wird durch intestinale und mikrobielle Proteasen noch während der Darmpassage abgebaut.
Im Blut wird Zonulin dagegen kaum degradiert. Der Blutwert erlaubt deshalb auch eine Aussage über höher liegende Darmabschnitte (Duodenum,Dünndarm). Die Zonulinwerte im Blut passen daherauch meist besser zu den aktuellen klinischen Beschwerden (Reizdarm, Schmerzen, Entzündung)und den messbaren Sekundärfolgen eines leaky gut(Mineralstoffmangel, Aufnahme toxischer Metalle),da der Dünndarm für die Verdauung und Resorption von Nährstoffen, aber auch toxischen Substanzen,wegen seiner größeren Fläche und der direkten Anbindung an das hepatische Pfortadersystem bedeutender als der Dickdarm ist.
Aus den genannten Gründen bietet das IMD die Zonulin-Bestimmung im Stuhl nicht mehr an, sondern nur noch im Blut (Serum).
Mehr zu diesem Thema finden Sie auf unserer Diagnostikinformation Nr.: 275
FAQ Kategorien
